Kelas 12 ipa 008 electrochemical cells voltaic cells
-
Upload
elizabeth-indah-pratiwi -
Category
Education
-
view
182 -
download
2
Transcript of Kelas 12 ipa 008 electrochemical cells voltaic cells
Hubungan reaksi kimia dengan arus listrik
•Pemanfaatan reaksi kimia (redoks) untuk menghasilkan listrik
•Pemanfaatan arus listrik untuk melangsungkan reaksi kimia
•Sel Volta (Voltaic Cells)
Dari reaksi kimia dihasilkan arus listrik contoh : penggunaan batu baterai dan aki
•Sel Elektrolisis (Electrolytic Cells)
Dari arus listrik yang dialirkan dihasilkan reaksi kimia
Contoh : penyepuhan, pemurnian logam dalam
pertambangan, penyetruman aki
•Sel Volta = Sel Galvani
Jenis Elektroda :
Katoda (kutub +) reduksi Anoda (kutub -) oksidasi
http://www.infoswis.com/voltaic-cell/
• Reaksi Redoks Sel Volta
K(+) : Cu+2(aq)+ 2ē Cu(s)
A(-) : Zn(s) Zn+2(aq) + 2ē
Reaksi sel : Cu+2(aq)+ Zn(s) Cu(s) + Zn+2(aq) +
• Reaksi Redoks Sel Volta
Reaksi sel : Cu+2(aq)+ Zn(s) Cu(s) + Zn+2(aq) Penulisan reaksi sel disederhanakan dengan diagram sel :
Zn Zn+2 Cu+2 Cu
Anoda Katoda
jembatan garam (utk menyetarakan/ mengekivalensikan kelebihan muatan masing” larutan)
Perhitungan Potensial Sel (Eosel)
Melihat data potensial reduksi suatu elektroda/ potensial sel elektroda standar (Eo)
Potensial reduksi yg lebih (+) mengalami reduksi (sebagai katoda)
EOsel = E
o(katoda) – Eo(anoda)
Contoh 1 :
Diketahui :
Tentukanlah :
a. Reaksi elektrode dan reaksi selnya
b. Eosel yang dihasilkan
c. Diagram sel
Fe+2 + 2ē Fe Eo = -0,44 V
Ag+ + ē Ag Eo = +0,80 V
Jawab :
Potensial reduksi yang lebih (+) adalah Ag, maka Ag+ mengalami reduksi
Katoda(+)/Reduksi : 2Ag+ + 2ē 2Ag EO = +0,80 V
Anoda(-)/Oksidasi Reaksi sel Diagram sel
: Fe Fe+2 + 2ē : 2Ag+ + Fe 2Ag + Fe+2
: Fe Fe+2 2Ag+ 2Ag
EO = +0,44 V EO = +1,24 V EO = +1,24 V
+
Contoh 2 :
Diketahui :
EO Ni+2 Ni = -0,25 V
EO Zn+2 Zn = -0,76 V
Tentukanlah :
a. Reaksi sel dan potensil sel yang dihasilkan
b. Diagram sel
Jawab :
Potensial reduksi yang lebih (+) adalah Ni, maka Ni+2 mengalami reduksi
Katoda(+)/Reduksi : Ni+2 + 2ē Ni EO = -0,25 V
Anoda(-)/Oksidasi Reaksi sel Diagram sel
: Zn Zn+2 + 2ē : Ni+2 + Zn Ni + Zn+2
: Zn Zn+2 Ni+2 Ni
EO = +0,76 V EO = +0,51 V EO = +0,51 V
+
Perkiraan Berlangsungnya Reaksi Redoks
Jika potensial sel hasil perhitungan bertanda (+), maka reaksi dapat berlangsung (spontan)
Jika potensial sel hasil perhitungan bertanda (-), maka reaksi tidak dapat berlangsung
Contoh 1 :
Diketahui :
EO Cd+2 Cd = -0,40 volt
EO Pb+2 Pb = -0,13 volt
Tentukanlah Esel persamaan reaksi:
Pb+2 + Cd Pb + Cd+2
Reaksi dapat berlangsung atau tidak !
Jawab :
Esel = EOreduksi – E
Ooksidasi
Esel = (-0,13 volt) – (-0,40 volt)
Esel = +0,27 volt
(reaksi dapat berlangsung spontan)
Contoh 2 :
Diketahui :
EO Fe+2 Fe = -0,44 volt
EO Al+3 Al = -1,66 volt
Tentukanlah Esel persamaan reaksi:
2Al+3 + 3Fe 2Al + 3Fe+2
Reaksi dapat berlangsung atau tidak !
Jawab :
Esel = EOreduksi – E
Ooksidasi
Esel = (-1,66 volt) – (-0,44 volt)
Esel = -1,22 volt
(reaksi tidak dapat berlangsung)
Deret Kereaktifan Logam
Susunan unsur-unsur logam berdasarkan potensial elektroda standarnya disebut deret elektrokimia atau deret volta Li,K,Ba,Ca,Na,Mg,Al,Mn,Zn,Cr,Fe,Cd,Ni,Co,Sn,Pb,(H),Cu,Hg,Ag,Pt,Au
Lina Kawan Bayu Caca Nangis Mengharap Ali Minta Zeni Cari Ferdi Cedang Niat Coni Sngaja Pacarin Bayu Huh Culit Hingga Anggi Putusin Aku
Deret Kereaktifan Logam
Kurang Reaktif (sukar melepas elektron)
Sifat Oksidator Semakin Kuat (Kationnya)
Li,K,Ba,Ca,Na,Mg,Al,Mn,Zn,Cr,Fe,Cd,Ni,Co,Sn,Pb,(H),Cu,Hg,Ag,Pt,Au
Logam Semakin Reaktif (mudah melepas elektron)
Sifat Reduktor Semakin Kuat (Logamnya)
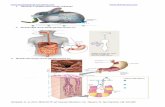
Kegunaan Sel Volta
a. Sel Volta Primer (sel baterai yang tidak dapat diisi lagi jika sumber energinya telah habis).
b. Sel Volta Sekunder (sel Volta yang jika habis dapat berfungsi lagi setelah dialiri arus listrik).
c. Sel Bahan Bakar (sel Volta dengan pereaksi – pereaksinya (oksigen dan hidrogen) dialirkan secara kontinyu ke dalam elektrode berpori).
Baterai Biasa (Sel Leclanche)
http://lurvsweetroses.blogspot.com/2013/01/tugas-kimia.html
A :Zn(s) → Zn2+(aq) + 2e- K :2MnO2(s) + 2NH4
+(aq) + 2e- → Mn2O3(s) + 2NH3(aq) + H2O(l)
Elektrolit yang digunakan pasta MnO2, NH4Cl dan sedikit air. NH3 yang terlarut dalam pasta bereaksi dengan Zn+2 membentuk ion kompleks Zn(NH3)4
+2, potensial sel yang dihasilkan 1,5 volt
Baterai Alkali
http://kimia-asyik.blogspot.com/2011/08/kegunaan-sel-volta.html
Sel ini menghasilkan energi lebih besar untuk waktu yang lama daripada baterai biasa, walaupun potensial sel sama 1,5 volt. Elektrolit yang digunakan adalah pasta KOH.
A :Zn(s) → Zn2+(aq) + 2e- K :2MnO2(s) + H2O(l) + 2e- → Mn2O3(s) + 2OH-(aq) Kemudian ion Zn+2 akan bereaksi dengan ion OH- membentuk Zn(OH)2
https://www.academia.edu/8449661/MAKALAH_PENERAPAN_SEL_VOLTA_DALAM_KEHIDUPAN_SEHARI-HARI
Umur baterai biasa diperpendek oleh korosi zink akibat keasaman NH4Cl. Sedangkan pada sel kering alkali bebas masalah ini karena penggantian NH4Cl yang bersifat asam dengan KOH/NaOH yang bersifat basa. Jadi umur sel kering alkali lebih panjang.Selain itu juga menyebabkan energi yang lebih kuat dan tahan lama.
Baterai Perak Oksida
Sel ini memiliki potensial sel sebesar 1,5 volt dan bertahan dalam waktu yang lama. Kegunaan baterai jenis ini adalah untuk arloji, kalkulator dan kamera. Elektrolit yang digunakan adalah pasta KOH
A :Zn(s) + 2OH-(aq) → Zn(OH)2(s) + 2e-
K :Ag2O(s) + H2O + 2e- → 2Ag(s) + 2OH-(aq)
Sel Aki/ Accu
Dalam baterai timbal, elektroda negatif adalah logam timbal (Pb) dan elektroda positifnya adala timbal yang dilapisi timbal oksida (PbO2), dan kedua elektroda dicelupkan dalam larutan elektrolit asam sulfat (H2SO4). Reaksi elektrodanya adalah sebagai berikut :
A: Pb + SO42- → PbSO4 + 2e
–
K: PbO2 + SO42- + 4H+ + 2e– → PbSO4 + 2H2O
Kondisi Saat aki digunakan : Saat aki menghasilkan listrik, Anoda Pb dan katoda PbO2 bereaksi dengan SO4
2- menghasilkan PbSO4. PbSO4 yang dihasilkan dapat menutupi permukaan lempeng anoda dan katoda. Jika telah terlapisi seluruhnya maka lempeng anoda dan katoda tidak berfungsi. Akibatnya aki berhenti menghasilkan listrik. Saat aki menghasilkan listrik dibutuhkan ion H+ dan ion SO4
2- yang aktif bereaksi. akibatnya jumlah ion H+ dan ion SO4
2- pada larutan semakin berkurang dan larutan elektrolit menjadi encer maka arus listrik yang dihasilkan dan potensial aki semakin melemah.
Oleh karena reaksi elektrokimia pada aki merupakan reaksi kesetimbangan (reversibel) maka dengan memberikan arus listrik dari luar ( mencas ) keadaan 2 elektroda (anoda dan katoda) yang terlapisi dapat kembali seperti semula. demikian pula ion akan terbentuk lagi sehingga konsentrasi larutan elektrolit naik kembali
seperti semula.
Sel Lithium
Baterai Litium ini dapat menghasilkan arus listrik yang lebih besar dan daya tahannya lebih lama dibandingkan baterai kering yang berukuran sama. Terdiri atas litium sebagai anoda dan MnO2 sebagai oksidator (seperti pada baterai alkaline).
Berikut notasi dari baterai Litium:
Li│Li+(pelarut non-air)│KOH (pasta)│MnO2, Mn(OH)3, C
Sel ini terdiri atas anode dari nikel, katode dari nikel oksida dan elektrolit KOH. Reaksi yang terjadi :
A: 2H2(g) + 4OH-(aq) → 4H2O(l) + 4e K: O2(g) + 2H2O(l) + 4e → 4OH-(aq) Sel bahan bakar ini biasanya digunakan untuk sumber energi listrik pesawat ulang-alik, pesawat Challenger dan Columbia.