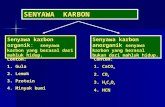
KECENDERUNGAN GOLONGAN KARBON
-
Upload
dita-persimala -
Category
Documents
-
view
57 -
download
10
Transcript of KECENDERUNGAN GOLONGAN KARBON

KECENDERUNGAN GOLONGAN KARBON, SILIKON DAN GERMANIUM
KECENDERUNGAN GOLONGAN KARBON, SILIKON DAN GERMANIUM
Karbon merupakan unsur ke-19 yang paling banyak terdapat di kerak bumi yaitu dengan
presentase berat 0,027%, dan menjadi unsur paling banyak ke-4 terdapat jagat raya setelah
hydrogen, helium, dan oksigen. Ditemukan baik di air, darat, dan atmosfer bumi, dan didalam
tubuh makhluk hidup. Karbon membentuk senyawaan hampir dengan semua unsur terutama
senyawa organic yang banyak menyusun dan menjadi bagian dari makhluk hidup.
Unsur karbon dengan lambang unsur C, di alam terdapat di dalam kerak bumi dalam
bentuk unsur bebas dan senyawa. Senyawa alamiah, karbon yang utama adalah zat-zat organik.
Unsur karbon sangat banyak membentuk senyawa “organik”. Atom karbon juga dapat dikatakan
unik karena dapat berikatan sesamanya membentuk rantai atom karbon. Karbon secara alamiah
terdapat dalam 2 bentuk kristalin (alotropi) yaitu :
1. Intan (diamond)
2. Grafit
3. Tetapi dewasa ini satu keluarga baru yang telah berhasil diindetifikasi Fulerena (Fullerence)
1. Intan
Intan bersifat tak berwarna, jernih, paling keras, sangat mudah patah menjadi berkeping-
keping dan tidak menghantarkan listrik. Intan banyak didapat tertanam dalam kanal-kanal batu
vulkanik.
Pemanfaatan Intan yaitu sebagai:
a. Pelapis alat-alat pemotong gelas dan baja
b. Batu permata
2. Grafit
Grafit berwarna hitam, lunak, dan mempunyai massa jenis 2,2 g/cm, mempunyai titik
leleh sangat tinggi, diraba halus dan licin sehingga dapat dipakai sebagai pelumas. Perbedaan
intan dan grafit Struktur kristalnya, namun pada dasarnya agak mirip.

Selain intan dan grafit, karbon dapat berada dalam berbagai bentuk, baik secara alamiah
maupun buatan, yaitu bentuk serbuk seperti coke, karbon hitam dan karbon aktif.
Coke merupakan karbon amorf yang dibuat dari pemanasan batubara pada temperatur
tinggi. Karbon aktif Bermanfaat untuk mengusir bau tidak sedap, pabrik-pabrik pengolah air
sering mengalirkan air melalui karbon aktif, juga pada pabrik air minum, buah-buahan juice.
Karbon Hitam dibuat dengan cara dekomposisi termal senyawa hidrokarbon pada
pembakaran terbuka, hasilnya berupa serbuk halus dan sangat murni.
3. Fulerena
Fulerena merupakan keluarga suatu struktur dimana atom-atom karbon tersusun dalam
struktur atau elips. Untuk itu atom-atom karbon membentuk lingkar 5 dan 6 anggota mirip pola
bola sepak, nama asal C60 yaitu soccerane. Salah satu metode pembuatan fulerena yaitu dengan
menggunakan sinar laser yang berintensitas tinggi untuk memanaskan grafit hingga temperatur
diatas 10000o C.
Beberapa senyawa karbon anorganik
Karbon monoksida (CO)
Karbon dioksida (CO2 )
Karbon disulfida (CS2 )
Karbontetrahalida
Klorofluorokarbon
Karbida
Sianida
Sianogen
Sianat
Tiosianat
Sianamida
Silikon
Atom silikon seperti halnya atom karbon, dapat membentuk empat ikatan secara serentak
silikon dalam susunan petrahedral, unsur Si mengkristal dengan struktur kubus pusat muka (fcc)
seperti intan, silikon bersifat semi konduktor. 85% kerak bumi disusun oleh silikon dioksida SiO2

(silika) dan mineral silikat. Unsur silikon kemurnian 98% dapat diperoleh dari reduksi pasir
(mengandung sebagian besar SiO2) dengan coke (C) atau kalsium karbida (CaC2 ) dalam tanur
listrik . Persamaan reaksi :
SiO2 + 2C Si + 2CO
Senyawa oksida silikon
Silika, Silika Gel, Silikat, Silikat Alam, Silikat sintetis, Silikona, Halida Silikon, Hidrida Silikon
Germanium
Germanium terdapat terutama sebagai senyawa sulfida yang terasosiasi dengan logam sulfida
lain seperti Pb dan Zn. Germanium murni mempunyai bentuk kristalin dengan kenampakan
metalik tetapi sangat rapuh seperti gelas. Untuk keperluan peralatan semikonduktor, pemurnian
silikon dan germanium melalui proses ”zone refining”.
Germanium (Ge) stabil di udara & air pd keadaan yg normal, & sukar bereaksi dgn alkali
& asam, kecuali dengan asam nitrat.
Diposkan oleh Nancy Sinabra di 03.29
Fakta Singkat Silikon
Nomor atom: 14
Massa atom: 28,0855 g/mol
Elektronegativitas menurut Pauling: 1,8
Densitas: 2,33 g/cm-3 pada 20 °C
Titik lebur: 1410 °C
Titik didih: 3265 °C
Radius Vanderwaals: 0,132 nm
Radius ionik: 0,271 (-4) nm, 0,041 (4)

Isotop: 5
Energi ionisasi pertama: 786,3 kJ/mol
Energi ionisasi kedua: 1.576,5 kJ/mol
Energi ionisasi ketiga: 3.228,3 kJ/mol
Energi ionisasi keempat: 4.354,4 kJ/mol
Ditemukan oleh: Jons Berzelius pada tahun 1823
Sifat Kimia dan Fisika Silikon
Silikon adalah unsur elektropositif yang paling melimpah di kerak bumi, bersifat metalloid
dengan kilap logam, dan sangat rapuh.
Silikon biasanya membentuk senyawa tetravalen meskipun kadang-kadang bivalen. Selain itu,
senyawa silikon pentacoordinated dan hexacoordinated juga umum dikenal.
Silikon alami terdiri dari 92,2% isotop silikon 28; 4,7% silikon 29; dan 3,1% silikon 30.
Silikon merupakan semikonduktor intrinsik dalam bentuknya yang paling murni, meskipun
intensitas semikonduktor bisa ditingkatkan dengan sejumlah kecil pengotor.
Silikon mirip dengan logam dalam perilaku kimianya. Unsur ini hampir sama elektropositif
seperti timah dan jauh lebih positif daripada germanium atau timbal.
Silikon membentuk berbagai hidrida, berbagai halida, dan banyak seri senyawa yang
mengandung oksigen, yang dapat memiliki sifat ionik atau kovalen.
Unsur ini memiliki kelimpahan jauh lebih banyak daripada unsur lainnya, selain dari oksigen.
Silikon merupakan penyusun 27,72% kerak bumi, sementara oksigen menyumbang 46,6%.

Penggunaan Silikon
Silikon merupakan komponen utama dari kaca, semen, keramik, sebagian besar perangkat
semikonduktor, dan silikon (zat plastik yang sering tercampur baur dengan logam silikon).
Silikon juga merupakan konstituen penting dari beberapa jenis baja dan merupakan bahan tahan
api yang digunakan dalam pembuatan enamel dan tembikar.
Unsur silikon dan senyawa intermetaliknya banyak digunakan sebagai paduan untuk membentuk
aluminium, magnesium, tembaga, dan logam lainnya yang memiliki ketahanan tinggi.
Silikon metalurgi dengan kemurnian 98-99% digunakan sebagai bahan baku dalam pembuatan
organosilicic dan resin silikon, segel, serta pelumas.
Dalam bidang elektronik, chip silikon digunakan dalam berbagai peralatan elektronik. Sel surya
juga menggunakan irisan tipis kristal silikon sebagai salah satu komponen utamanya.
Silikon dioksida digunakan sebagai bahan baku untuk memproduksi unsur silikon dan silikon
karbida. Kristal silikon berukuran besar digunakan untuk gelas piezoelektrik.
Dispersi koloid silikon dalam air digunakan sebagai agen pelapis dan sebagai bahan untuk
pembuatan enamel tertentu.
Efek Kesehatan Silikon
Silikon terutama ditemukan dalam jaringan ikat dan kulit.
Silikon merupakan unsur tidak beracun dalam bentuk alaminya seperti pada silika dan silikat.
Debu silikon memiliki sedikit dampak buruk pada paru-paru dan tidak memicu penyakit organik
signifikan.
Silikon dapat menyebabkan efek pernapasan kronis terutama dalam bentuk kristal silika (silikon
dioksida).

Namun, kemungkinan terbentuknya kristal silika di alam amat kecil. Kristal silika umumnya
akan mempengaruhi orang-orang yang bekerja di pertambangan, di industri tembikar,
pertambangan granit, dan industri yang melibatkan tanah diatom.
Kristal silikon dikenal mengiritasi kulit dan mata. Menghirup komponen ini akan menyebabkan
iritasi pada paru-paru dan selaput lendir.
Beberapa penelitian epidemiologi melaporkan angka signifikan atas kematian atau kasus
gangguan imunologi pada pekerja yang terpapar silika.
Penyakit dan gangguan yang ditemui termasuk skleroderma, rheumatoid arthritis, lupus
eritematosus sistemik, dan sarkoidosis.
Dampak Silikon terhadap Lingkungan
Tidak ada efek negatif silikon terhadap lingkungan telah dilaporkan.[]
MAKALAH KARBON
makalah karbon
BAB I PENDAHULUAN
A. Latar Balakang
Karbon merupakan salah satu unsur dari unsur-unsur yang terdapat dalam golongan IV
A dan merupakan salah unsur terpenting dalam kehidupan sehari-hari karena terdapat
lebih banyak senyawaan yang terbentuk dari unsur karbon.
Keistimewaan karbon yang unik adalah kecenderungannya secara alamiah untuk
mengikat dirinya sendiri dalam rantai-rantai atau cincin-cincin,tidak hanya dengan
ikatan tunggal, C - C , tetapi juga mengandung ikatan ganda C = C, serta rangkap
tiga,C≡C.Akibatnya, jenis senyawa karbon luar biasa banyaknya. kini diperkirakan

terdapat sekitar dua juta jenis senyawa karbon,dan jumlah itu makin meningkat dengan
laju kira-kira lima persen per tahun.Alasan bagi kestabilan termal rantai-rantai karbon
adalah kekuatan hakiki yang tinggi dari ikatan tunggal C - C.
Konfigurasi elektron karbon dalam keadaan dasar adalah (1s2 2s2 2p2) mudah
terhibridasi menghasilkan perangkat orbital sp3, atau sp2+p, atau sp+p2. Lebih dari
sembilan puluh persen senyawa karbon merupakan senyawa sintetik, sedangkan
sisanya diperoleh dari mahluk hidup (tumbuh-tumbuhan,hewan,jamur,dan
mikroorganisme) serta fosil mereka (batubara dan minyak bumi).
B. Rumusan Masalah
Permasalahan yang akan kami bahas dalam makalah ini adalah sebagai berikut:
a.Sifat fisik dari karbon
b. Sifat kimia dari karbon
c. Alotropi karbon
d. Senyawa anorganik karbon
C. Tujuan
1. Mendeskripsikan sifat dan karekteristik unsur karbon
2. Menjelaskan 2 bentuk karbon
3. Menjelaskan senyawa-senyawa yang terbentuk dari unsur karbon
BAB II
PEMBAHASAN
A. Sejarah Karbon
(Latin: carbo, arang) Karbon, suatu unsur yang telah ditemukan sejak jaman pra-
sejarah sangat banyak ditemukan di alam. Karbon juga banyak terkandung di matahari,
bintang-bintang, komet dan amosfir kebanyakan planet. Karbon dalam bentuk berlian
mikroskopik telah ditemukan di dalam beberapa meteor yang jatuh ke bumi. Berlian
alami juga ditemukan di kimberlite pipa gunung berapi, di Afrika Selatan, Arkansas dan
beberapa tempat lainnya. Berlian sekarang ini diambil dari dasar samudera di lepas

pantai Cape of Good Hope. Sekitar 30% berlian industri yang dipakai di AS sekarang ini
merupakan hasil sintesis.
Energi dari matahari dan bintang-bintang dapat diatribusikan setidaknya pada siklus
karbon-nitrogen.
B. Keunikan atom Karbon
Meskipun karbon hanyalah salah satu unsur dari sekian banyak unsur dalam sistem
periodik, tetapi atom karbon dapat terikat secara kovalen dengan atom karbon yang lain
dan terhadap unsur-unsur lain menurut beragam cara sehingga dapat membentuk
beegitu banyak senyawa yang jumlahnya hamper tak terhingga. Atom karbon dan
senyawanya dapat dibedakan menjadi enpat jenis yaitu :
a. Atom C primer : atom C yang mengikat 1 atom C yang lain
b. Atom C sekunder : atom C yang mengikat 2 atom C yang lain
c. Atom C tersier : atom C yang mengikat 3 atom C yang lain
d. Atom C kuarter : atom C yang mengikat 4 atom C yang lain
Karbon dapt membentuk lebih banyak senyawa dibandingkan unsure lain sebab atom
karbbon tidak hanya dapat membentuk ikatan-ikatan karbon tunggal, rangkap dua dan
rangkap tiga, tetapi juga bias terkait satu sama lain membentuk struktur rantai dan
cincin.
C. Bentuk karbon
Karbon ditemukan di alam dalam tiga bentuk alotropik: amorphous, grafit dan berlian.
Diperkirakan ada bentuk keempat, yang disebut karbon “putih�. Ceraphite
(serafit) merupakan bahan terlunak, sedangkan belian bahan yang terkeras. Grafit
ditemukan dalam dua bentuk: alfa dan beta. Mereka memiliki sifat identik., kecuali
struktur kristal mereka. Grafit alami dilaporkan mengandung sebanyak 30% bentuk
beta, sedangkan bahan sintesis memiliki bentuk alfa. Bentuk alfa hexagonal dapat
dikonversi ke beta melalui proses mekanikal, dan bentuk beta kembali menjadi bentuk
alfa dengan cara memanaskannya pada suhu di atas 1000 derajat Celcius.
Pada tahun 1969, ada bentuk alotropik baru karbon yang diproduksi pada saat
sublimasi grafit pirolotik (pyrolytic graphite) pada tekanan rendah. Di bawah kondisi

free-vaporization (vaporisasi bebas) di atas 2550K, karbon terbentuk sebagai kristal-
kristal tranparan kecil pada tepian grafit..
1. Sifat-sifat Unsur Karbon
Karbon dioksida ditemuka di atmosfir bumi dan terlarut dalam air. Karbon juga
merupakan bahan batu besar dalam bentuk karbonat unsur-unsur berikut: kalsium,
magnesium, dan besi. Batubara, minyak dan gas bumi adalah hidrokarbon. Karbon
sangat unik karena dapat membentuk banyak senyawa dengan hidrogen, oksigen,
nitrogen dan unsur-unsur lainnya. Dalam banyak senyawa ini atom karbon sering terikat
dengan atom karbon lainnya. Ada sekitar sepuluh juta senyawa karbon, ribuan di
antaranya sangat vital bagi kehidupan. Tanpa karbon, basis kehidupan menjadi
mustahil. Walau silikon pernah diperkirakan dapat menggantikan karbon dalam
membentuk beberapa senyawa, sekarang ini diketahui sangat sukar membentuk
senyawa yang stabil dengan untaian atom-atom silikon. Atmosfir planet Mars
mengandung 96,2% CO2.
Beberapa senyawa-senyawa penting karbon adalah karbon dioksida (CO2),
karbon monoksida (CO), karbon disulfida (CS2), kloroform (CHCl3), karbon tetraklorida
(CCl4), metana (CH4), etilen (C2H4), asetilen (C2H2), benzena (C6H6), asam
cuka(CH3COOH) dan turunan-turunan mereka.
C. Sifat Fisika dan Kimia Unsur Karbon
a. Sifat Fisika
Fasa pada suhu kamar : padat
Bentuk kristalin : intan dan grafit
Massa jenis : 2,267 g/cm³ (grafit) dan 3,513 g/cm³ (diamond)
Titik leleh : 4300-4700 K
Titik didih : 4000 K
Densitas : 2,267 g/cm3 (grafit) 3,515 g/cm3 (diamond)
Kalor lebur : 100 kJ/mol (grafit ) dan 120 kJ/mol (diamond)
Kalor uap : 355,8 kJ/mol
Kalor jenis : 8,517 J/molK (grafit) dan 6,115 J/molK (diamond)

b. Sifat Kimia
Bilangan oksidasi : 4,3,2,1,0,-1,-2,-3,-4
Elektronegatifitas : 2,55 (skala pauli)
Energi ionisasi : 1086 kJ/mol
Energi ionisasi ke-2 : 2352,6 kJ/mol
Energi ionisasi ke-3 : 4620,5 kJ/mol
Jari-jati atom : 70 pm
Jari-jari kovalen : 77 pm
Jari-jari Vander Waals : 170 pm
konduktifitas termal : 119-165 (grafit) 900-2300 (diamond) W/mK
Struktur Kristal : heksagonal

Sifat Kimia yang Lain Berdasarkan Bentuk Alotrop
Alotrop adalah sifat sejumlah tertentu unsur dimana unsur ini mampu berada
dalam dua tau lebih bentuk, pada setiap alotrop atom-atom unsur tersebut berikatan
dengan cara yang berbeda sehingga membentuk modifikasi struktur yang berbeda
pula. Berbagai macam alotrop karbon adalah:
Diamond
Diamond adalah salah satu contoh alotrop yang terbaik dari karbon dan memiliki
nilai ekonomi yang tinggi, dimana sifatnya yang keras dan memiliki optikal optis
sehingga banyak dipakai dalam berbagai industri dan untuk bahan baku perhiasan.
Diamond menjadi mineral alami terkeras yang pernah ada, tidak ada unsur alam yang
dapat memotong diamond maupun menarik (merenggangkan) diamond.
Setiap karbon yang terdapat dalam diamond berikatan secara kovalen pada
empat atom karbon yang lain dalam bentuk geometri tetrahedarl. Dan tetrahedarl ini
membentuk 6 cincin karbon seperti sikloheksana dalam bentuk konformasi “kursi”
sehingga hal ini mengakibatkan tidak adanya sudut ikatan yang mengalami
ketegangan. Jalinan struktur kovalen yang stabil inilah membuat sifat diamond menjadi
keras.
Panjang ikatan tunggal pada diamond adalah 0,154 nm. Dengan struktur kristal
kubus perbusat muka dan densitasnya sekitar 3,51 g/cm3. Diamond yang murni
memiliki indeks refraktori sebesar 2,465 pada 397 nm, 2.427 at 527 nm, 2.417 at 589
nm, 2.408 at 670 nm, and 2.402 at 763 nm.
Gambar. Struktur Diamond
Grafit
Grafit merupakan alotrop karbon. Tidak seperti diamond grafit bersifat konduktor
sehingga dapat dipakai untuk elektroda dalam proses elektrolisis. Sifat daya hantar ini
disebabkan grafit memiliki elektron dalam orbital pi yang terdelokalisasi dibawah dan
diatas bidang karbon. Ikatan yang terdapat dalam grafit adalah sp2 dengan bentuk

datar/plane dengan sudut 120 derajat. Elektron ini dapat bergerak bebas sejauh dalam
lapisan karbon.
Grafit lebih reaktif dibandingkan dengan karbon, disebabkan reaktan dapat
menetrasi diantara lapisan heksagonal grafit. Tidak bereaksi dengan asam encer atau
basa dan dapat dioksidasi oleh asam kromat menjadi CO2.
Grafit tidak mencair akan tetapi mengalami sublimasi pada suhu 3500 C. Kristal
grafit memiliki dua bentuk yaitu alfa-grafit dengan bentuk heksagonal dan beta grafit
dengan bentuk rombohedral.
Grafit adalah mineral yang dapat berasal dari batuan beku, sedimen, dan metamorf.
Grafit adalah suatu modifikasi dari karbon dengan sifat yang mirip logam (penghantar
panas dan listrik yang baik). Di samping tidak cukup padat, grafit tidak terdapat dalam
jumlah banyak di alam. Oleh karena itu,untuk keperluan peralatan teknik serta
pembuatan elektroda, grafit harus dibuat secara sintetik.
Pembuatan: Grafit alam atau grafit yang dibuat dari kokas diperkecil ukurannya,
dicampur dengan ter atau resin sintetik,kemudian dipanaskan sehingga membentuk
padatan (sintering) dalam 105 cetakan.
Grafit dinamai oleh Abraham Gottlob Werner pada tahun 1789 dengan mengambil kata
dari bahasa Yunani.
Gambar. Struktur Grafit
Grafena
Grafena merupakan lapisan tunggal dari grafit dengan ikatan karbon sp2
membentuk susunan seperti sarang lebah (monolayer grafit). Ikatan karbon-karbon
memiliki panjang 0,142 nm. Grafena merupakan struktur dasar dari grafit, karbon nano,
dan fuleren, dan dapat didiskripsikan sebagai lapisan molekul aromatic.
Gambar. Struktur Grafen

Karbon Amorfos
Karbon amorfos atau disebut sebagai karbon reaktif, merupakan alotop karbon
dimana tidak memiliki struktur kristalin. Karbon amorfos biasa disingkat sebagai aC
untuk karbon amorfos yang biasa, aC:H untuk karbon amorfos yang terhidrogenasi, dan
ta-C untuk tetrahedral karbon amorfos (seperti diamond). Dalam bidang mineralogy,
karbon amorfos biasa digunakan untuk istilah coal dan jenis karbon yang tak murni
selain grafit dan diamond.
Fuleren
Fuleren merupakan molekul yang keseluruhannya dibangun oleh atom karbon
dalam bentuk hollow, bulatan (sphere), ellipsoidal, atau tube. Fuleren yang berbentuk
spherical disebut buckyballs, dan yang berbentuk silinder disebut sebagai karbon
nanotube atau buckytubes. Fuleren memiliki struktur seperti grafit akan tetapi hanya
dibangun dari grafena yang saling berhubungan satu sama lain. Penemuan fuleren
menjadikan alotrop karbon semakin bervariasi dan menjadi subyek penelitan yang
penting untuk elektronik, ilmu bahan, dan nanoteknoligi.
Fullerene ditemukan pada oleh Robert Curl, Harold Kroto, dan Richard Smalley
di Universitas Sussex dan Universitas Rice tahun 1985, yang dinamai berdasarkan
Richard Buckminster Fuller yang menciptakan kubah geodesik
Gambar. Struktur Fuleren

Senyawa-senyawa Populer yang Berikatan dengan Unsur Karbon
Senyawa Anorganik Karbon
1. Karbon monoksida(CO)
Karbon monoksida dapat dibuat secara komersil dengan hidrogen melalui
pembentukan uap kembali atau pembakaran sebagian hidrokarbon dengan reaksi:
CO2 + H2 → CO + H2O
Gas ini tidak berwarna dan mempunyai titik didih -190. Dapat digunakan sebagai
bahan bakar industri melalui reaksi:
2CO(g) +O2(g)→2CO2(g)
Gas CO juga dapat trjadi sebagai hasil samping pembakaran senyawa organik
dalam ruang kurang oksigen.
C8H18 +6O2(g) → 8CO +4H2O
Secara besar-besaran dapat dibuat dengan reaksi:
C(S) + H2O → CO +H2
Gas CO sangat berbahaya bagi manusia maupun hewan, karena CO berikatan
kuat dengan hemoglobin darah.hemoglobin berfungsi mengedarkan oksigen dari paru-
paru ke seluruh tubuh. Orang yang mengisap CO akan kekurangan oksigen dan dapat
berakibat fatal.
2. Karbon Dioksida(CO2)
Karbon dioksida mempunyai struktur molekul linier dan bersifat non polar. Gas ini
larut dalam air.terdapat diudara dan sangat penting bagi tumbuhan sebagai bahan
fotosintesis serta merupakan komponen nafas yang dikeluarkan oleh hewan ataupun
manusia, karena dihasilkan dari oksidasi makanan dalam tubuh.
CO2 dapat dibuat dengan membakar karbon senyawa hidrokarbon, atau gas CO
dengan oksigen yang cukup.
C + O2 → CO2
CH4 + 2O2 → CO2 + H2O
2CO + O2 → 2CO2

Dilaboratorium gas CO2 dapat dibuat dengan mereaksikan garam karbonat
dengan asam seperti :
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Gas CO2 tidak beracun,tetapi konsentrasi yang terlalu tinggi dalam udara adalah
tidak sehat, karena merendahkan konsentrasi O2 dan menimbulkan efek fisikologis
yang membahayakan.
Jumlah CO2 yang sangat besar sekali. dihasilkan oleh aktifitas manusia,
meningkatnya gas CO2 dikhawatirkan atmosfer mungkin menjadi begitu panas,
sehingga akan muncul perubahan suhu yang serius yang sering juga disebut efek
rumah kaca.
3. Karbonat dan Bikarbonat
Karbonat dan bikarbonat adalah senyawa yang melimpah dan sangat berguna
serta terkenal. Kebanyakan karbonat hanya sedikit larut dalam air. Misalnya CaCO3,
BaCO3, MgCO3 dan PbCO3. Banyak bikarbonat hanya stabil dalam larutan air.
Contohnya ialah Ca(HCO3)2, Mg(HCO)3. Semua logam IA kecuali Litium membentuk
karbonat yang larut, dimana yang paling murah dan berguna adalah NaHCO3 (Soda
kue), Na2CO3 (Soda abu).
4. Karbon Disulfida(CS2)
CS2 adalah cairan yang mudah terbakar dan dapat dipakai sebagai bahan pembuat
CCl4,dengan reaksi:
CS2 + 3Cl2 → CCl4 +S2Cl2
Keberadaan Unsur Karbon di Alam
Keberadaan karbon di alam terjadi dalam dua wujud, yang pertama dalam wujud
mineral dan yang kedua dalam wujud grafit. Intan merupakan wujud mineral dari
karbon. Ini disebabkan satu atom karbon berikatan kovalen dengan empat atom karbon
lain sehingga membentuk geometri molekul tetrahedral, molekul berkembang ke segala
arah menjadi molekul yang sangat keras. Arang, wujud grafit dari karbon, juga terikat
dengan empat atom kabon yang lain, tetapi geometri molekulnya tidak membentuk
tetrahedral, karena hanya ada tiga ikatan yang berikatan kovalen tetap sedangkan yang

satu ikatan lagi membentuk ikatan kovalen sesaat dengan atom karbon lapisan atas
dan bawah secara bergantian.
Selain itu, unsur karbon di alam juga terdapat di dalam kerak bumi dalam bentuk
unsur bebas dan senyawa. Senyawa alamiah karbon yang utama adalah zat-zat
organik, misalnya senyawa organik dalam jaringan tubuh makhluk hidup baik tumbuhan
maupun hewan. Selain itu, dalam bahan yang berasal dari benda hidup seperti arang
dan minyak bumi. Juga terdapat dalam senyawa organik komersial, misalnya senyawa
asam asetat (CH3COOH) dan freon (CFC). Senyawa karbon lainnya adalah senyawa
karbon anorganik, yaitu senyawa karbondioksida (CO2) dan batuan karbonat (CO3)
yang dikenal sebagai mineral seperti karbonat dari unsur IIA (MgCO3, SrCO3, dan
BaCO3). Juga kebanyakan terdapat dalam senyawa karbonat dan bikarbonat, misalnya
senyawa natrium karbonat (Na2CO3) dan natrium bikarbonat (NaHCO3).
Di dalam kehidupan sehari-hari, karbon memang sangat berperan, terutama
pada mahluk hidup. Sebagian besar mahluk hidup mengandung atom karbon, ini dapat
diketahui jika mahluk hidup tersebut dibakar maka akan menyisakan zat yang berwarna
hitam, seperti kayu dibakar, binatang dibakar atau bahkan manusia yang terbakar. Zat
hitam sisa dari pembakaran itu adalah karbon.
Kegunaan unsur karbon
Karbon adalah suatu unsur yang sangat luwes dan berguna. Kegunaan karbon
hanya akan jelas terlihat apabila kita sebutkan satu persatu dalam berbagai bentuk
kehidupan sehari-hari. Berdasarkan unsurnya kegunaan karbon terbagi menjadi dua,
yaitu:
a. Grafit, baik yang alamiah maupun sintetik mempunyai banyak kegunaan.
Kegunaannya itu di antaranya untuk bahan hitam dalam pensil biasa, pigmen dalam cat
hitam, bahan pembuatan krus (mangkok untuk bahan kimia), elektode untuk
penggunaan pada suhu yang sangat tinggi, pelumas kering, bila serbuk grafit
didispersikan dengan minyak akan dihasilkan pelumas cair.
b. Intan, terutama yang bernoda dan kecil-kecil digunakan dalam industri untuk
membuat bubuk penggosok yang paling keras untuk roda pengasah, ujung mata bor
dan gigi gergaji.

Selain itu, karbon juga diperlukan untuk pigmen hitam di dalam tinta cetak untuk
buku, majalah dan surat kabar, kertas karbon, bahan bakar mobil, semir sepatu,
penguat dan pengeras bahan karet, ban dalam dan barang-barang karet, dan sebagai
unsur penting untuk konstruksi bermacam-macam peralatan listrik dan nuklir, mulai dari
sapu penyedot debu untuk rumah tangga sampai dinamo yang paling besar dan rektor
nuklir. Busur karbon digunakan untuk membuat radiasi tampak dan ultraviolet dalam
sejumlah besar proses industri yang bergantung pada reaksi fotokimia.
Karbon juga memiliki manfaat dibidang pertanian yaitu sebagai pembangun
bahan organik karena sebagian besar bahan kering tanaman terdiri dari bahan organik,
diambil tanaman berupa CO2.
Karbon juga berperan dalam pembuatan baja. Baja adalah logam paduan, logam
besi sebagai unsur dasar dengan karbon sebagai unsur paduan utamanya. Kandungan
unsur karbon dalam baja berkisar antara 0.2% hingga 2.1% berat sesuai grade-nya.
Fungsi karbon dalam baja adalah sebagai unsur pengeras dengan mencegah dislokasi
bergeser pada kisi kristal (crystal lattice) atom besi. Unsur paduan lain yang biasa
ditambahkan selain karbon adalah (titanium), krom (chromium), nikel, vanadium, cobalt
dan tungsten (wolfram). Dengan memvariasikan kandungan karbon dan unsur paduan
lainnya, berbagai jenis kualitas baja bisa didapatkan. Penambahan kandungan karbon
pada baja dapat meningkatkan kekerasan (hardness) dan kekuatan tariknya (tensile
strength), namun di sisi lain membuatnya menjadi getas (brittle) serta menurunkan
keuletannya (ductility).
Sedangkan kegunaan karbon berdasarkan persenyawaannya, yaitu:
Gas CO2 dalam air akan membentuk senyawa H2CO3. Asam karbonat H2CO3,
bila ditambahkan ke dalam minuman (minuman berkarbonasi), akan memberikan rasa
tajam yang menyegarkan. Asam karbonat H2CO3, merupakan bahan baku untuk
pembuatan garam-garam karbonat.
CO2 dalam udara berfungsi untuk menjaga suhu permukaan bumi pada malam
hari agar tidak terlalu dingin. CO2 dalam udara dapat menyerap sinar infra merah (sinar
yang mengandung energi panas) dari sinar matahari yang dipantulkan bumi. Pada
malam hari CO2 melepaskan infra merah tersebut ke permukaan bumi yang dingin
sehingga permukaan bumi menjadi hangat.

Kerugian Karbon
Adapun senyawa karbon mempunyai dampak negatif sebagai berikut :
Karbon disulfida CS2, beracun bila terserap kulit serta mudah terbakar dan meledak
terutama bila mengalami gesekan,
Karbon tetraklorida CCl4, beracun bila tertelan, terhisap, dan terserap kulit. Selain
itu pemicu terjadinya kanker,
Sifat CO2 yang dapat menyerap sinar infra merah lalu memantulkannya kembali ke
permukaan bumi disebut efek rumah kaca (green house effect). Akan tetapi, bila kadar
CO2 terlalu besar di udara dapat mengakibatkan suhu permukaan bumi bertambah
panas sehingga terjadi pemanasan global (pemanasan yang merata di permukaan
bumi). Akibat dari pemanasan global di permukaan bumi tersebut, es di kutub akan
mencair dan dapat menimbulkan banjir di kota-kota pantai seluruh dunia.
BAB III
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Karbon merupakan unsur utama dalam senyawa organik dan anorganik yang begitu
banyak jumlah dan jenisnya
2. Karbon mengisi tempat khusus diantaranya unsur-unsur dalam keragaman dan
kekompleksan dalm senyawa yang dapat dibentuknya.
3. Karbon juga merupakan zat padat yang tegar, yang biasa diangggap sebagai
molekul raksasa yang tediri dari banyak sekali atom.
4. Karbon terbentuk dalam dua bentuk kristalin yaitu :

• Grafit, yang merupakan zat hitam yang benar-benar terasa berminyak sebagai bubuk
kering yang digunakan sebagai pelumas.
• Intan, yang merupakan zat padat tidak berwarna yang bisa diasah menjadi kristal-
kristal gemerlapan yang merupakan mineral yang paling keras dan paling baik untuk
menggosok. Intan biasa dikenan orang merupakan molekul besar yang melebar dari
toga dimensi (ruang) sehingga atom-atomnya terikat sangat kuat satu sama lain. Hal ini
mengakibatkan intan sangat keras.
B. Saran
1. Diharapkan dengan adanya makalah ini mampu membantu mahasisiwa untuk
menjawab masalah-masalah dalam kimia khususnya yang menyamgkut hal yang
berkaitan dengan unsur karbon
2. Diharapkan kepada pembaca agar mampu memberikan saran yang memabangun
untuk pembuatan makalah selanjutnya agar lebih baik dari yang telah ada sekarang.
3. Diharapkan makalah ini mampu menambah literatur di perpustakaan untuk
menambah pengetahuan pembaca khusunya mahasiswa
DAFTAR PUSTAKA
Cotton, F.A. dan Wilkinson, G. 1989. Kimia anorganik I. Jakarta: Universitas Indonesia.
Green Wood, N.N dan Earshshaw, A., 1989. Chemistry of Elements. Newyork
Pergamon Press.
Keenan Kleinfelter,W. 1991. Kimia Untuk Universitas. Jakarta: Erlangga.
H Petruci, Ralph.1987. Kimia Dasar Prinsip dan Terapan Modern. Bogor.
S.Sukri.1999.Kimia Dasar III. Bandung: ITB.
Sugiyarto, Kristian H. Kimia Anorganik 1. Yogyakarta: Universitas Negeri Yogyakarta

Alotrop Karbon: Karakteristik Grafit, Berlian & Karbon
Amorf
Amazine.co - Online Popular Knowledge
Baca juga
Informasi & Fakta Berlian: Si Cantik dengan Harga Selangit
Tips Permata: 4 Faktor Penentu Kualitas & Harga Berlian
Tips Permata: Mengenal Cubic Zirconia, si Berlian Imitasi
Karbon merupakan unsur non-logam yang diwakili oleh simbol ‘C’ dan memiliki nomor atom 6.
Secara kimiawi, karbon merupakan unsur yang sangat stabil serta menjadi unsur ke-15 paling
berlimpah di kerak bumi.
Sedangkan bila dihitung dari nilai persentase massa, unsur ini ditemukan paling berlimpah ke-4
di seluruh alam semesta.
Dalam kimia, karbon dikenal memiliki isotop dan alotrop. Isotop mengacu pada terjadinya dua
atau lebih atom dari unsur yang sama namun memiliki jumlah neutron yang berbeda.

Sedangkan alotrop didefinisikan sebagai terjadinya suatu unsur dalam dua atau lebih bentuk
struktural yang berbeda.
Alotrop Karbon
Seperti sudah disebutkan, karbon bisa muncul dalam konfigurasi molekul bervariasi.
Tiga alotrop karbon diketahui ditemukan berlimpah di alam yaitu grafit, berlian, dan karbon
amorf.
Ketiga alotrop terbentuk ketika karbon mengalami kondisi yang berbeda. Misalnya, karbon
menjadi grafit akibat terpapar tekanan normal, sementara berlian terbentuk akibat karbon terkena
tekanan tinggi.
Jenis sistem kristal dalam grafit adalah heksagonal dan isometrik pada berlian.
1. Grafit
Grafit terbentuk ketika karbon terkena kondisi tekanan normal.
Itu sebab, grafit merupakan alotrop paling stabil dalam kondisi normal. Grafit memiliki
karakteristik lunak, ringan, dan mampu menghantarkan listrik.
Secara komersial, grafit digunakan sebagai pelumas. Bila terkena suhu dan tekanan yang sangat
tinggi, grafit dapat dikonversi menjadi berlian.
2. Berlian
Bernilai memiliki nilai tinggi sebagai perhiasan karena memiliki kemampuan menatulkan cahaya
yang unik.
Berlian memiliki karakteristik transparan, kompak, abrasif, serta dikenal sebagai mineral paling
kuat.

Selain sebagai perhiasan, berlian digunakan untuk aplikasi komersial seperti alat potong, alat
bor, dan alat giling.
Berlian tidak dapat menghantarkan listrik sehingga dikenal sebagai insulator yang baik.
3. Karbon amorf
Seperti namanya, karbon amorf merupakan alotrop berwujud non-kristal dan ditemukan dalam
bentuk bubuk serta menjadi komponen utama dari arang dan jelaga.
Namun, saat memeriksa struktur molekul secara rinci, Anda dapat menemukan kristal kecil yang
mirip dengan grafit dan berlian.
Oleh karena itu, karbon amorf sering dianggap sebagai bentuk varian dari grafit. Karbon amorf
dapat disintesis dalam kondisi yang terkendali di laboratorium.
Alotrop Lain
Selain tiga jenis yang disebutkan di atas, karbon juga memiliki alotrop lain termasuk glassy
carbon, fullerene, lonsdaleite, aggregated diamond nanorod, dan carbon nanofoam.[]
Tentang
Kimia
Biologi
Sejarah
Fisika
Kesehatan
Bank Soal
Psikologi
Matematika

PKn
8 Fungsi Unsur Karbon dan Alotrop Karbon
April 8, 2015 | By tatang | Leave a response
Nama unsur Karbon berasal dari kata Latin untuk arang, carbo. Unsur Karbon mempunyai:
Nomor atom: 6
Berat atom: 12,0107
Titik lebur: 3823 K (3550 ° C atau 6422 ° F)
Titik didih: 4098 K (3825 ° C atau 6917 ° F)
Kepadatan: 2,2670 gram/cm3
Fasa pada Suhu Kamar: Padat
Klasifikasi unsur: Non-logam
Nomor periode: 2
Nomor golongan: 14
Perkiraan Kelimpahan di kerak bumi: 2.00 × 102 miligram per kilogram
Perkiraan Kelimpahan di laut: 2,8 × 101 miligram per liter
Jumlah Isotop Stabil: 2
Energi ionisasi: 11,260 eV
Bilangan oksidasi: +4, +2, -4
Konfigurasi kulit elektron: 1s2 2s2 2P2

Intan bentuk alotrop karbon
Sejarah
Karbon, unsur keenam yang paling melimpah di alam semesta, telah dikenal sejak zaman kuno.
Karbon ini paling sering diperoleh dari cadangan batubara, meskipun biasanya harus diolah
menjadi bentuk yang sesuai untuk penggunaan komersial.
Alotrop Karbon
Tiga alotrop alami karbon diketahui ada: amorf, grafit dan berlian.
Karbon amorf
Karbon amorf terbentuk ketika bahan yang mengandung karbon dibakar tanpa oksigen yang
cukup untuk membakar sepenuhnya. Jelaga hitam ini, juga dikenal sebagai jelaga, hitam gas,
saluran hitam atau karbon hitam, digunakan untuk membuat tinta, cat dan produk karet. Hal ini
juga dapat ditekan menjadi bentuk dan digunakan untuk membentuk inti dari sebagian besar sel
baterai kering.
Grafit
Grafit, salah satu bahan terlembut diketahui, adalah bentuk karbon yang terutama digunakan
sebagai pelumas. Meskipun hal itu terjadi secara alami, grafit komersial diproduksi dengan
memperlakukan kokas minyak bumi, residu tar hitam yang tersisa setelah penyempurnaan dari
minyak mentah, dalam oven bebas oksigen. Grafit alami terjadi dalam dua bentuk, alpha dan
beta. Kedua bentuk memiliki sifat fisik yang identik, tetapi struktur kristal yang berbeda. Semua
grafit artifisial yang dihasilkan adalah dari jenis alpha. Selain digunakan sebagai pelumas, grafit,
dalam bentuk yang dikenal sebagai kokas, digunakan dalam jumlah besar dalam produksi baja.
Coke dibuat dengan memanaskan batubara lembut dalam oven tanpa membiarkan oksigen untuk
campuran dengan zat itu. Bahan hitam yang digunakan dalam pensil sebenarnya grafit.

Diamond/IntanS
Diamond, bentuk alami ketiga karbon, merupakan salah satu zat yang paling sulit dikenal.
Meskipun alami berlian biasanya digunakan untuk perhiasan, sebagian besar berlian kualitas
komersial secara artifisial diproduksi. Meskipun mereka dimiliki sifat fisik yang sangat berbeda,
grafit dan berlian hanya berbeda dalam struktur kristal mereka.
Kegunaan Karbon
1. Diamond /intan digunakan untuk perhiasan.
2. Jelaga hitam karbon digunakan untuk membuat tinta, cat dan produk karet.
3. Jelaga hitam karbon digunakan untuk membentuk inti dari sebagian besar sel baterai
kering.
4. Grafit digunakan sebagai pelumas
5. Grafit dalam bentuk kokas digunakan dalam jumlah besar pada produksi baja.
6. Isotop radioaktif Carbon-14 digunakan untuk mencari usia fosil melalui proses
penanggalan radiokarbon
7. Sebuah karbon putih mampu menahan tekanan besar dan memiliki sifat magnetik dan
superkonduktif.
8. Unsur Karbon penyusun senyawa organik yang bermanfaat bagi manusia.
Sebuah alotrop keempat karbon, yang dikenal sebagai karbon putih, diproduksi pada tahun 1969.
Ini adalah bahan transparan yang dapat membelah seberkas cahaya menjadi dua sinar. Molekul
besar yang terdiri hanya dari karbon, yang dikenal sebagai buckminsterfullerenes, atau bulky
balls, baru-baru ini ditemukan digunakan subyek banyak kepentingan ilmiah. Sebuah buckyball
tunggal terdiri dari 60 atau 70 atom karbon (C-60 atau C-70) dihubungkan bersama dalam
sebuah struktur yang terlihat seperti bola sepak. Mereka dapat menjebak atom lain dalam
kerangka mereka, tampaknya mampu menahan tekanan besar dan memiliki sifat magnetik dan
superkonduktif.

Carbon-14, isotop radioaktif karbon dengan paruh 5.730 tahun, digunakan untuk mencari usia
fosil melalui proses yang dikenal sebagai penanggalan radiokarbon. Teori di balik penanggalan
karbon cukup sederhana. Para ilmuwan tahu bahwa sejumlah kecil alami karbon adalah karbon-
14. Meskipun karbon-14 meluruh menjadi nitrogen-14 melalui peluruhan beta, jumlah karbon-14
di lingkungan tetap konstan karena karbon-14 baru selalu diciptakan di bagian atas atmosfer
oleh sinar kosmik. Makhluk hidup cenderung menelan bahan yang mengandung karbon,
sehingga persentase karbon-14 dalam makhluk hidup adalah sama dengan persentase karbon-14
di lingkungan. Setelah suatu organisme mati, tidak lagi mencerna apa-apa. Karbon-14 di dalam
organisme yang tidak lagi diganti dan persentase karbon-14 mulai menurun karena meluruh.
Dengan mengukur persentase karbon-14 di sisa-sisa organisme, dan dengan asumsi bahwa
kelimpahan alami karbon-14 tetap konstan dari waktu ke waktu, para ilmuwan dapat
memperkirakan kapan organisme yang mati. Sebagai contoh, jika konsentrasi karbon-14 di sisa-
sisa organisme adalah setengah dari konsentrasi alami karbon-14, ilmuwan akan memperkirakan
bahwa organisme meninggal sekitar 5.730 tahun yang lalu, waktu paruh karbon-14.
Ada hampir sepuluh juta senyawa karbon dikenal dan seluruh cabang ilmu kimia, yang dikenal
sebagai kimia organik, dikhususkan untuk studi mereka. Banyak senyawa karbon sangat penting
bagi kehidupan seperti yang kita kenal. Beberapa senyawa karbon yang paling umum adalah
karbon dioksida (CO2), karbon monoksida (CO), karbon disulfida (CS2), kloroform (CHCl3),
karbon tetraklorida (CCl4), metana (CH4), etilen (C2H4), asetilena ( C2H2), benzene (C6H6), etil
alkohol (C2H5OH) dan asam asetat (CH3COOH).
CATATAN:
GAMBAR ALOTROP KARBON
KECENDERUNGAN GOLONGAN KARBON