Auksin Translate
-
Upload
annisa-kecil -
Category
Documents
-
view
104 -
download
4
description
Transcript of Auksin Translate

18
Hormones I: Auxins
Tanaman multiseluler adalah organisme kompleks dan pengembangan tertib mereka membutuhkan ukuran yang luar biasa koordinasi antara sel-sel. Dalam rangka untuk mengkoordinasikan kegiatan mereka, sel-sel harus mampu berkomunikasi satu sama lain. Sarana utama komunikasi antar dalam tanaman adalah hormon. Hormon adalah molekul sinyal yang secara individu atau kooperatif mengarahkan perkembangan sel-sel individual atau membawa informasi yang antara sel-sel dan dengan demikian mengkoordinasikan pertumbuhan dan perkembangan. Hormon tanaman telah menjadi subjek penyelidikan intensif sejak auksin yang pertama ditemukan hampir satu abad yang lalu.
Pembahasan masing-masing hormon dalam hal ini dan selanjutnya bab akan dimulai dengan review dari biosintesis dan metabolisme. Pemahaman biokimia hormon membuat lebih mudah untuk memahami apa jenis molekul mereka dan bagaimana mereka dapat berfungsi. Selain itu, banyak dari apa yang diketahui tentang apa molekul ini lakukan dan bagaimana mereka melakukannya berdasarkan penelitian dari mutan yang mengganggu biosintesis atau metabolisme mereka. Omset metabolisme molekul hormon juga merupakan faktor yang signifikan dalam regulasi kegiatan selular.
ini pertama dari empat bab tentang hormon tanaman dikhususkan untuk auksin. Bab-bab berikut akan mencakup giberelin, sitokinin, asam absisat, etilen, dan brassinosteroids. Dalam kasus setiap hormon, kita akan membahas hal yang sama tiga pertanyaan dasar: apa itu, apa fungsinya, dan bagaimana cara melakukannya?
Karena ini adalah pertama bab tentang hormon, kita akan mulai dengan pengenalan konsep hormon pada tanaman. Saldo bab mencakup
• biokimia dan metabolisme auksin,• review dari efek utama auksin pada pertumbuhan dan perkembangan,• bagaimana auksin mengontrol pembesaran sel,• transportasi auksin di pabrik, dan• Kontrol auksin ekspresi genetik.
18.1 THE HORMONE CONCEPT IN PLANTS
Konsep hormon, para utusan kimia yang memungkinkan sel-sel untuk berkomunikasi dengan satu sama lain, muncul dalam studi fisiologi mamalia. Yang terakhir setengah abad kesembilan belas menyaksikan kemajuan yang menarik dalam fisiologi dan obat-obatan. Dengan 1850, diketahui bahwa zat darah-ditanggung berasal dari testis AC karakteristik seksual. Pada saat yang sama, dokter mengejar studi klinis telah menjadi tertarik pada efek ekstrak kelenjar dan sekresi pada kursus berbagai penyakit. Pada pergantian abad, sejumlah zat yang menimbulkan efek tertentu pada pertumbuhan dan fisiologi mamalia telah ditunjukkan dan konsep yang fungsi tubuh dikoordinasikan oleh produksi dan peredaran bahan kimia yang mendapatkan penerimaan luas. Pada tahun 1905, dokter Inggris EH Starling memperkenalkan hormon jangka (Gr., Untuk menggairahkan atau membangkitkan) untuk menggambarkan ini utusan kimia.
Penerapan konsep hormon tanaman dapat ditelusuri sejauh pengamatan Duhamel du Monceau di 1758. Du Monceau diamati pembentukan akar pada pembengkakan yang terjadi di atas luka korset yang terganggu jaringan floem sekitar batang tanaman berkayu. Untuk menjelaskan ini dan yang sejenis fenomena, ahli botani Jerman Julius Sachs (ca. 1860) mendalilkan zat organ pembentuk tertentu pada tanaman. Sachs mendalilkan bahwa zat akar-membentuk, misalnya, diproduksi di daun dan bermigrasi ke batang, akan menjelaskan inisiasi akar di atas luka. Awal yang sebenarnya dari hormon tanaman penelitian, bagaimanapun, ditemukan dalam serangkaian percobaan sederhana namun elegan yang dilakukan oleh Charles Darwin (lihat Kotak 18.1). Itu
1

pengamatan dan eksperimen Darwin yang pada akhirnya menyebabkan FW Pergi, hampir setengah abad kemudian, untuk menggambarkan zat hormonal seperti sebagai agen penyebab ketika tanaman tumbuh ke arah cahaya. Pada waktu yang sama, H. Fitting memperkenalkan hormon jangka ke literatur fisiologi tanaman.
Apa hormon? Hormon yang terjadi secara alami, molekul organik yang, pada konsentrasi rendah, memberikan pengaruh besar pada proses fisiologis. Selain itu, hormon, seperti yang didefinisikan oleh ahli fisiologi hewan, adalah (1) disintesis di organ diskrit atau jaringan, dan (2) diangkut dalam aliran darah ke jaringan target tertentu di mana mereka (3) mengontrol respon fisiologis dalam konsentrasi tergantung cara. Meskipun ada banyak persamaan antara hormon hewan dan tumbuhan, ada juga beberapa perbedaan yang signifikan. Seperti hormon hewan, hormon tanaman yang alami zat organik yang sangat mempengaruhi proses fisiologis pada konsentrasi rendah. Tempat sintesis dan mode transportasi untuk hormon tanaman, bagaimanapun, tidak selalu lokal begitu jelas. Meskipun beberapa jaringan atau bagian dari jaringan dapat ditandai dengan kadar hormon lebih tinggi daripada yang lain, sintesis hormon tanaman tampaknya jauh lebih menyebar dan tidak selalu dapat diterjemahkan ke organ diskrit.
Hormon dapat melayani secara efektif sebagai sinyal pengatur hanya jika molekul memiliki seumur hidup terbatas dalam sel target. Setiap molekul cukup lama-hidup untuk digunakan berulang kali akan mengorbankan dinamis, fungsi pengatur. Ini berarti bahwa jumlah hormon di kolam selular harus diatur jelas dan menunjukkan tingkat turnover metabolisme yang cepat relatif terhadap respon yang mengontrol. Jumlah hormon tersedia untuk sel target akan diatur terutama oleh tingkat di mana molekul hormon aktif masuk (input) dan keluar (output) kolam hormon. Hormon dapat masuk kolam renang dengan (1) de novo sintesis hormon, (2) pengambilan hormon aktif dari bentuk penyimpanan tidak aktif, seperti konjugat kimia, dan (3) transportasi hormon ke dalam kolam dari sebuah situs di tempat lain di tanaman. Sarana utama untuk menghilangkan hormon dari kolam
setelah telah bertindak meliputi: (1) oksidasi atau bentuk lain dari degradasi kimia yang membuat molekul aktif atau (2) sintesis dari ireversibel dinonaktifkan konjugat. Jelas, untuk memahami peraturan dinamis aktivitas hormon pada tanaman, adalah penting untuk mengetahui sesuatu dari input dan output tersebut. Tidak ada pemahaman tentang fungsi hormon bisa lengkap tanpa pengetahuan tentang biosintesis hormon dan metabolisme.
18,2 auksin didistribusikan ke seluruh TANAMANAuksin (fr. G. auxein, untuk meningkatkan) adalah hormon tanaman klasik. Auksin adalah hormon tanaman pertama yang ditemukan dan memiliki peran utama dalam paling mendasar dari respon-tanaman pembesaran sel tumbuhan. Auksin disintesis di daerah meristematik dan organ tumbuh aktif lain seperti apeks koleoptil, ujung akar, biji berkecambah, dan tunas apikal tumbuh batang (Gambar 18.1). Muda, daun berkembang pesat, berkembang perbungaan, dan embrio berikut penyerbukan dan pembuahan juga situs yang signifikan dari sintesis auksin. Auksin, lebih dari substansi pertumbuhan lainnya, tampaknya didistribusikan secara aktif di seluruh pabrik.
18.3 THE PRINCIPAL AUXIN INPLANTS IS INDOLE-3-ACETIC ACID (IAA)
(IAA) adalah auksin alami didistribusikan paling banyak (Gambar 18.2). Selain IAA, beberapa turunan indol alami lain yang dikenal untuk mengekspresikan aktivitas auksin, termasuk indole-3-etanol, indole-3-
2

asetaldehida, dan indole-3-asetonitril. Namun, senyawa ini semua berfungsi sebagai prekursor untuk IAA dan aktivitas mereka adalah karena konversi ke IAA dalam jaringan. Penemuan awal IAA pada tanaman dan pengakuan dari perannya dalam pertumbuhan dan perkembangan dirangsang pencarian bahan kimia lainnya dengan kegiatan serupa. Hasilnya telah array bahan kimia sintetis yang mengekspresikan aktivitas auksin seperti. Salah satu bahan kimia ini adalah indole-3-butirat asam (IBA) (IV, Gambar 18.2). Baru-baru ini, IBA telah diisolasi dari biji dan daun jagung dan beberapa jenis lainnya. Sebuah analog diklorinasi IAA (asam 4-chloroindoleacetic, atau 4-chloroIAA; II, Gambar 18.2) juga telah dilaporkan dalam ekstrak biji legum dan terkait erat, alami asam aromatik, fenil asam asetat (PAA) (III, Gambar 18,2) baru-baru ini dilaporkan memiliki aktivitas auksin. Karena IBA, 4-chloroIAA, andPAA kini telah diisolasi dari tanaman, secara struktural mirip dengan IAA, dan menimbulkan banyak tanggapan yang sama seperti IAA, ada argumen yang kuat untuk mengingat mereka hormon alami. Namun, belum jelas apakah mereka aktif pada mereka sendiri atau apakah mereka pertama dikonversi ke IAA. Kimia, karakter pemersatu tunggal molekul yang mengekspresikan aktivitas auksin tampaknya menjadi rantai samping asam pada cincin aromatik.
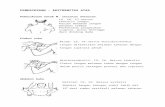
GAMBAR 18.2 struktur kimia dari beberapa alami dan sintetis auksin. Indole-3-acetic acid (I) diyakini menjadi auksin aktif dalam semua tanaman. asam fenilasetat (III) tersebar luas dan dua
orang lain, 4-chlorindole-3-asam asetat dan asam indole-3-butyric, telah diidentifikasi dalam ekstrak tumbuhan. Yang terakhir tiga menginduksi respon auksin bila diterapkan secara eksogen, tapi mungkin bertindak melalui konversi ke IAA. Struktur VI, VII, dan VIII yang herbisida aktif.
Jumlah IAA ini akan tergantung pada sejumlah faktor, seperti jenis dan usia jaringan dan keadaan pertumbuhan. Dalam jaringan vegetatif, misalnya, jumlah IAA umumnya jatuh dalam kisaran antara 1 mg dan 100 mg (5,7-570 nanomoles) kg-1 berat basah, tapi dalam biji tampaknya menjadi jauh lebih tinggi. Dalam sebuah penelitian, diperkirakan bahwa endosperm dari jagung benih tunggal empat hari setelah perkecambahan mengandung 308 picomoles (pmole = 10-12 mol) dari IAA. Pada saat yang sama, menembak jagung terkandung 27 pmoles IAA dan diperlukan masukan diperkirakan sekitar 10 pmoles IAA hr-1 untuk mendukung pertumbuhannya. Tingginya tingkat IAA dalam benih tampaknya berfungsi untuk mendukung pertumbuhan yang cepat dari bibit muda saat berkecambah benih
18,4 IAA DISINTESIS DARI AMINO ACID L-TRYPTOPHAN
Sejak tahun 1930-an, ketika KV Thimann pertama kali diamati sintesis IAA dalam cetakan Rhizopus suinus, yang telah makan asam amino triptofan, konversi triptofan untuk IAA telah dipelajari secara in vivo di lebih dari 20 spesies tanaman yang berbeda dan in vitro dengan setidaknya 10 persiapan enzim bebas sel yang berbeda. Sintesis IAA biasanya dipelajari dengan memberi makan tanaman triptofan membawa label radioaktif, biasanya karbon (14C) atau tritium (3H), dan memeriksa radioaktivitas kemudian diisolasi IAA atau intermediet nya.
Makan eksperimen rumit oleh beberapa faktor dan hasilnya harus selalu didekati dengan hati-hati. Misalnya, triptofan radiolabeled ternyata dapat mengalami dekomposisi radiokimia, sehingga menimbulkan IAA oleh reaksi nonenzimatik. Selain itu, ukuran kolam renang triptofan (prekursor juga untuk sintesis protein) relatif sangat besar dengan yang IAA dan ada sedikit data tentang jumlah sebenarnya IAA disintesis. Akhirnya, perawatan harus
3

dilakukan untuk memastikan bahwa percobaan dilakukan dalam kondisi steril, karena banyak mikroorganisme mudah mengubah triptofan untuk IAA. Sementara komplikasi ini membuat sulit untuk memastikan jalur yang tepat yang berfungsi in vivo, bukti yang ada dengan jelas menetapkan bahwa tanaman dapat mensintesis IAA dari triptofan.
Pada kebanyakan tanaman, sintesis IAA terjadi dalam tiga langkah, dimulai dengan penghapusan gugus amino pada rantai samping triptofan. Produk ini asam indole-3-piruvat (IPA) (Gambar 18.3). Reaksi ini dikatalisis oleh transferase tryptophanamino, enzim multispecific didistribusikan secara luas yang muncul untuk bertindak serta untuk menghapus kelompok amino dari analog struktural dari triptofan seperti fenilalanin dan tirosin. Langkah kedua adalah dekarboksilasi dari IPA untuk membentuk indole-3-asetaldehida (IAAld). Enzim yang mengkatalisis langkah ini, indole-3-piruvat dekarboksilase, telah dijelaskan dalam beberapa jaringan tanaman dan ekstrak bebas sel. Akhirnya, IAAld dioksidasi menjadi IAA oleh indole-3-asetaldehida oksidase tergantung AD. Kehadiran enzim ini telah dibuktikan dalam sejumlah jaringan, termasuk oat koleoptil. IAAld juga dapat reversibel dikurangi menjadi indole-3-etanol.
Indole-3-etanol aktif dalam bioassay menggunakan bagian batang, tapi ini mungkin karena konversi kepada IAA dalam jaringan. Akhirnya, IAA dapat reversibel dikonversi ke IBA oleh enzim indole-3-butyric acid synthase.Ada beberapa bukti untuk jalur biosintesis alternatif yang melibatkan intermediet selain IPA, tetapi beban bukti biokimia menunjukkan bahwa jalur IPA adalah jalur utama untuk sintesis IAA dari triptofan pada tumbuhan tingkat tinggi. MeskipunMutan IAA-kekurangan mungkin diharapkan untuk memberikan informasi lebih lanjut yang berguna, tidak ada telah diidentifikasi sampai saat ini. Ini mungkin karena kekurangan IAA mungkin akan mematikan.
18,5 BEBERAPA TANAMAN TIDAK MEMERLUKAN TRYPTOPHAN UNTUK IAA
4

BIOSINTESISBukti untuk biosintesis IAA melalui jalur triptofan-independen telah diperoleh dari mutan dari kedua jagung dan Arabidopsis. Bibit jeruk pericarp (ORP) mutan dari Zea mays kekurangan enzim sintase tryptophan, yang mengkatalisis langkah terakhir dalam sintesis triptofan (lihat Gambar 18.3). Meskipun biji membawa mutasi ORP berkecambah normal, mereka tidak bertahan karena kapasitas berkurang mereka untuk sintesis triptofan. IAA konten bibit mutan, bagaimanapun, adalah sebanyak 50 kali lipat lebih tinggi dari bibit wildtype. Beberapa mutan tryptophan-membutuhkan juga telah diisolasi dari Arabidopsis. Dua dari mutan, trp2 dan trp3, juga kekurangan triptofan synthase dan tidak dapat mengkonversi indole-3-gliserol fosfat untuk tryptophan. Bibit trp2 dan trp3, tidak seperti ORP, tidak menumpuk gratis IAA tetapi mereka mengandung peningkatan kadar terkonjugasi IAA (lihat di bawah). Rupanya, trp2 dan trp3 toko kelebihan IAA dalam bentuk terkonjugasi. Percobaan radioisotop-label baik jagung dan Arabidopsis telah mengkonfirmasi bahwa IAA disintesis dari beberapa prekursor selain triptofan.
Jalur yang tepat untuk tryptophan-independen IAA sintesis tidak diketahui. Namun, trp2 dan trp3 mutan Arabidopsis yang menumpuk indole-3-asetonitril. Arabidopsis juga mengandung enzim nitrilase diperlukan untuk mengkonversi indole-3-asetonitril untuk IAA, sehingga berimplikasi indole-3-asetonitril sebagai perantara. Sumber indole-3-asetonitril tidak diketahui, meskipun akumulasi dalam mutan triptofan menunjukkan jalur triptofan-independen untuk biosintesis indole-3-asetonitril juga. Hal ini diketahui bahwa indole-3-asetonitril dapat diturunkan dari glucobrassicin, yang glukosinolat utama yang ada di anggota keluarga Cruciferae. Rincian indole-3-asetonitril jalur triptofan-independen untuk auksin biosintesis dan apakah itu terbatas pada Arabidopsis atau brassica, atau lebih luas, tetap ditentukan.
18,6 IAA MUNGKIN TERSIMPAN SEBAGAI KONJUGAT TIDAK AKTIF
Sangat awal dalam studi auksin, dua populasi hormon diakui seorang pun bebas bergerak dan bisa diperoleh dengan difusi ke dalam agar; yang lain muncul untuk
terikat dalam sel dan dapat diisolasi hanya dengan ekstraksi dengan pelarut atau dengan hidrolisis dalam kondisi basa. Populasi terakhir ini, disebut sebagai '' auksin terikat, '' sekarang diakui sebagai IAA yang telah terbentuk konjugat kimia dengan gula untuk membentuk ester glikosil. Konjugat dibentuk oleh esterifikasi dari glukosa atau molekul inositol untuk kelompok asam dari rantai samping (Gambar 18.4). Konjugat IAA-glikosil itu sendiri tidak aktif tapi mereka melepaskan gratis, biologis aktif IAA pada ekstraksi pelarut, hidrolisis basa, atau hidrolisis enzimatik in vivo.
Meskipun data kuantitatif yang kurang bagi sebagian besar tanaman, kolam besar IAA glikosil ester telah dibuktikan dalam biji Zea mays. Kolam ini dari IAA konjugat terbentuk dalam endosperm susu sebagai benih mengembangkan dan muncul untuk menjadi sumber penting dari hormon aktif untuk embrio selama beberapa hari pertama berkecambah. Diperkirakan, misalnya, bahwa sebanyak 60 persen dari kebutuhan IAA dari tunas berkecambah jagung dapat dipenuhi oleh hidrolisis konjugat IAA awalnya disediakan oleh endosperm. Karena sebagian besar dari pengetahuan kita tentang rilis IAA oleh hidrolisis konjugat berasal dari studi dengan berkecambah benih, itu belum diketahui apakah konjugasi hidrolisis sama pentingnya dalam pertumbuhan tanaman dewasa.
18,7 IAA DINONAKTIFKAN OLEH OKSIDASI DAN KONJUGASI DENGAN ASAM AMINO
IAA dalam larutan air relatif stabil dan mudah terdegradasi oleh berbagai agen, termasuk asam, ultraviolet dan radiasi pengion, dan cahaya tampak, yang terakhir terutama di hadapan kepekaan pigmen seperti riboflavin. IAA degradasi in situ, namun, muncul terutama karena oksigen dan peroksida, baik secara terpisah atau dalam kombinasi, dengan adanya sistem redoks yang sesuai.
Inaktivasi dari Avena pertumbuhan-mempromosikan zat oleh ekstrak air daun pertama kali dilaporkan pada tahun 1930, bahkan sebelum prinsip aktif diidentifikasi sebagai IAA. Enzim yang bertanggung jawab untuk menonaktifkan IAA pertama kali diisolasi dari ekstrak tumbuhan pada tahun 1940 dan disebut IAA oksidase. Kemudian, peroksidase enzim,
5

dalam konser dengan flavoprotein, ditampilkan untuk mengkatalisis oksidasi IAA sementara pada saat yang sama melepaskan CO2. The dekarboksilasi oksidatif IAA oleh peroksidase sekarang dikenal identik dengan IAA oksidase. Dalam dekarboksilasi oksidatif vitro dari IAA telah dipelajari paling luas dengan dimurnikan horseradish peroksidase. Karena produk akhir IAA oksidasi secara fisiologis tidak aktif, IAA oksidasi adalah cara yang efektif untuk menghilangkan molekul hormon setelah telah dicapai tujuannya. Studi terbaru lebih dengan buah-buahan hijau tomat, Kara Oncet, dan spesies lain telah menunjukkan bahwa konjugasi IAA dengan asam amino seperti alanin atau asam aspartat juga menyebabkan deaktivasi ireversibel (Gambar 18.4).
18,8 AUKSIN TERLIBAT DALAM HAMPIR SETIAP TAHAP PERKEMBANGAN TANAMAN
Auxins ditandai terutama oleh kemampuan mereka untuk merangsang pemanjangan sel di batang yang dipotong dan bagian koleoptil, tetapi mereka juga terlibat dalam berbagai tanggapan perkembangan lainnya, termasuk inisiasi sekunder akar, diferensiasi pembuluh darah, dan pengembangan tunas ketiak, bunga, dan buah-buahan . Auksin juga merupakan komponen penting dalam rantai sinyal yang memungkinkan akar dan tunas untuk menanggapi gravitasi dan cahaya unilateral. Bahkan, auksin terlibat dalam hampir setiap tahap pertumbuhan dan perkembangan tanaman dari organisasi embrio awal berbunga dan perkembangan buah.
18.8.1 THE PRINCIPAL TES UNTUK auksin ADALAH STIMULASI SEL PEMBESARAN DI JARINGAN dipotong
Peraturan pembesaran sel dalam Avena koleoptil adalah dasar untuk penemuan dan tindakan ini telah dibuktikan berulang kali dengan jaringan tanaman yang dipotong seperti jaringan koleoptil subapical dan segmen batang dipotong dari bibit kacang gelap tumbuh.
Kurva auksin konsentrasi-respons biasanya menunjukkan respon yang meningkat dengan meningkatnya konsentrasi auksin sampai konsentrasi optimum tercapai (Gambar 18.5). Konsentrasi melebihi optimal khas menghasilkan pengurangan
pertumbuhan. Jika konsentrasi auksin cukup tinggi, pertumbuhan dapat dihambat dibandingkan dengan kontrol.
Fitur lain yang karakteristik auksin fisiologi adalah bahwa utuh batang dan koleoptil tidak menunjukkan respon yang signifikan untuk aplikasi eksogen hormon. Rupanya isi auksin endogen jaringan utuh cukup tinggi untuk mendukung elongasi maksimum dan menambahkan auksin memiliki efek tambahan sedikit atau tidak ada. Oleh karena itu, aturan umum yang mempengaruhi dari eksogen disediakan auksin pada pembesaran sel dapat ditunjukkan hanya pada jaringan yang telah dihapus dari pasokan auksin normal. Ini termasuk segmen dipotong dari batang dan koleoptil atau jaringan dikultur pada media buatan.
18.8.2 AUKSIN MENGATUR VASCULAR DIFERENSIASI
Selain merangsang pembesaran sel, auksin juga memiliki peran dalam mengatur diferensiasi selular. Sistem yang paling banyak dipelajari adalah induksi vascular diferensiasi dalam tunas, yang berada di bawah kendali auksin diproduksi di muda, daun berkembang pesat. Produksi helai xilem di dasar dari Coleus tangkai daun, misalnya, berbanding lurus dengan aliran diffusible IAA bergerak melalui tangkai daun. Defoliasi dari Coleus epicotyls sangat mengurangi diferensiasi xilem di tangkai daun, tetapi efek ini dapat dibalik dengan menerapkan jumlah setara dengan IAA di pasta lanolin.
Sebuah sistem favorit untuk studi diferensiasi vaskular adalah regenerasi pembuluh dan tabung saringan floem sekitar luka di Coleus batang, yang juga di bawah kendali auksin (Gambar 18.6). Coleus, seperti anggota lain dari keluarga mint (Lamiaceae), memiliki karakteristik persegi batang dengan bundel vaskuler di setiap sudut. Jika sayatan berbentuk baji dibuat yang mengganggu salah satu dari ini ikatan pembuluh, sel parenkim di daerah luka akan berdiferensiasi menjadi elemen vaskular baru. Elemen vaskular ini pada akhirnya akan membangun kembali kontinuitas dengan bundel asli.
Diferensiasi kedua elemen xilem dan tabung saringan floem sekitar luka terbatas dan dikendalikan oleh
6

pasokan auksin. Hal ini dapat ditunjukkan dengan penghapusan daun (sumber auksin) di atas luka, misalnya, yang mengurangi regenerasi pembuluh darah. Di sisi lain, karena auksin bergerak istimewa bawah batang, penghapusan daun bawah luka memiliki sedikit atau tidak berpengaruh. Selanjutnya, tingkat regenerasi vaskular berbanding lurus dengan pasokan auksin ketika auksin eksogen digantikan daun. Secara umum, diferensiasi tabung saringan floem disukai oleh konsentrasi auksin yang rendah (0,1% IAA w / w di lanolin) sementara diferensiasi xilem disukai oleh konsentrasi auksin yang lebih tinggi (1,0% IAA w / w di lanolin).
Auksin juga diperlukan untuk diferensiasi vaskular dalam kultur jaringan tanaman. Ketika tunas, yang merupakan sumber auksin, yang ditanamkan ke gumpalan jaringan kalus terdiferensiasi dalam budaya, diferensiasi kalus parenkim ke dalam jaringan pembuluh darah terjadi di daerah-daerah yang berdekatan dengan implan. Efek yang sama dicapai ketika wedges agar yang mengandung IAA dan gula diganti untuk tunas implan.
7

18.8.3 AUKSIN CONTROLS PERTUMBUHAN TUNAS KETIAK
Sebagai menembak terus tumbuh dan meristem apikal meletakkan primordia daun baru, kelompok-kelompok kecil sel di axil yang (sudut antara batang dan daun primordial) dari primordia menjadi terisolasi dari meristem apikal dan menghasilkan tunas ketiak. Dalam beberapa kasus, seperti kacang (Phaseolus), tunas terus tumbuh, meskipun pada tingkat yang jauh lebih lambat dari tunas apikal. Dalam banyak tanaman, bagaimanapun, mitosis dan ekspansi sel di tunas ketiak ditangkap pada tahap awal dan tunas gagal untuk tumbuh. Telah diketahui untuk beberapa waktu bahwa penghapusan apeks pucuk, teknik hortikultura umum untuk memproduksi tanaman lebat, merangsang tunas ketiak untuk melanjutkan pertumbuhan (Gambar 18.7). Rupanya bud apikal
mampu memberikan pengaruh yang dominan yang menekan pembelahan sel dan pembesaran di tunas ketiak. Untuk alasan ini, fenomena perkembangan tunas terkoordinasi dikenal sebagai dominasi apikal.
Tak lama setelah auksin pertama kali ditemukan, KV Thimann dan F. Skoog mempertanyakan apakah mungkin ada hubungan antara kapasitas ujung tunas untuk melepaskan auksin dan kapasitasnya untuk menekan ketiak tunas pembangunan-dengan kata lain, adalah dominasi apikal dikendalikan oleh auksin? Thimann dan Skoog menguji gagasan ini dengan memenggal kepala kacang luas (Kara Oncet) tanaman dan menerapkan auksin untuk memotong tunggul. Pengembangan tunas ketiak tetap ditekan dengan adanya auksin. Sejak demonstrasi awal ini, kapasitas auksin untuk menggantikan ujung menembak dalam mempertahankan dominasi apikal telah dikonfirmasi
8

berulang kali. Bagaimana auksin dari apeks pucuk menekan perkembangan tunas ketiak? Teori yang paling banyak diterima menyatakan bahwa konsentrasi auksin yang optimal untuk pertumbuhan tunas ketiak jauh lebih rendah daripada untuk pemanjangan batang. Aliran auksin mengalir keluar dari apeks pucuk menuju dasar tanaman diduga mempertahankan konsentrasi hambat auksin pada tunas ketiak.
Penghapusan ini pasokan auksin oleh pemenggalan mengurangi pasokan auksin di wilayah tunas ketiak dan dengan demikian mengurangi tunas inhibisi. Bukti langsung lebih untuk peran transportasi auksin yang ditawarkan oleh pengamatan bahwa inhibitor transportasi auksin (TIBA dan NPA) merangsang pelepasan tunas dari dominasi ketika diterapkan pada batang antara apeks pucuk dan tunas. Selain itu, garis tomat yang menunjukkan percabangan produktif (yaitu, tidak adanya dominasi apikal) juga gagal untuk mengekspor berlabel radioaktif IAA dari apeks pucuk.
18,9 THE ACID-PERTUMBUHAN HIPOTESIS MENJELASKAN AUKSIN PENGENDALIAN PEMBESARAN CELL
Apapun tindakan utama, auksin dapat mengubah laju ekspansi sel hanya dengan akhirnya mempengaruhi satu atau lebih dari parameter sebelumnya diidentifikasi dalam persamaan 17.1 (Bab 17). Peningkatan laju pertumbuhan, misalnya, akan memerlukan peningkatan dinding diperpanjang (m), peningkatan tekanan turgor (P), atau penurunan ambang batas yield (Y). (Konduktansi hidrolik, L, dari membran plasma tergantung pada kehadiran aquaporins dan tidak biasanya parameter yang membatasi.) Pengukuran langsung dari P, menggunakan probe micropressure, telah menunjukkan bahwa tekanan turgor tidak berubah secara signifikan selama peningkatan auksin-dirangsang di tingkat pertumbuhan bagian kacang batang. Meskipun Y tidak dapat diukur secara langsung, hasil tes tidak langsung menunjukkan bahwa ambang batas yield tidak berubah baik. Yang meninggalkan diperpanjang, m. Diperpanjang sulit untuk menilai. Hal ini di satu sisi koefisien tingkat, tetapi juga ukuran kapasitas dinding sel untuk menjalani ireversibel (plastik) deformasi. Sejumlah tes untuk mengukur diperpanjang telah dirancang.
Apapun metode, namun, jawabannya adalah selalu sama-induksi sel yang cepat pembesaran oleh auksin disertai dengan peningkatan besar dan cepat dalam dinding diperpanjang.
Peran pH rendah dalam pembesaran sel diperkenalkan dalam Bab 17. Pada saat yang sama bahwa hubungan antara pH asam dan pembesaran sel menjadi jelas, itu juga menemukan auksin yang akan menyebabkan sel-sel yang tumbuh untuk mengeluarkan proton. Beberapa bukti menunjukkan bahwa sekresi proton merupakan pusat pembesaran sel auksin-ditingkatkan. (1) Dengan Avena koleoptil pH apoplastic, atau dinding sel, solusi tetes 5,7-4,7 dalam waktu 8 sampai 10 menit dari aplikasi auksin. Periode lag ini konsisten dengan periode lag diamati antara Selain auksin dan awal respon pertumbuhan. (2) sekresi proton Auksin-dirangsang adalah proses tergantung energi dihambat oleh inhibitor metabolisme dan inhibitor pertumbuhan auksin diinduksi. (3) Jika ruang dinding bagian koleoptil yang disusupi dengan buffer netral untuk mencegah perubahan pH, pertumbuhan auksin yang disebabkan hampir sepenuhnya meningkatkan dinding diperpanjang dan memungkinkan untuk ekspansi sel turgor diinduksi seperti yang dijelaskan sebelumnya pada Bab 17. Meskipun auksin tidak meningkatkan aktivitas pompa ATPase-proton di membran plasma, auxin sendiri tidak mengikat ke ATPase. Karena itu, harus ada reseptor auksin yang memulai rantai transduksi sinyal yang menghubungkan kehadiran auksin dengan peningkatan aktivitas ATPase. Sebuah reseptor auksin diduga telah diisolasi dari jagung (Zea mays), tetapi rincian dari rantai transduksi sinyal itu sendiri tetap tidak jelas. Reseptor jagung auksin adalah protein membran-terkait ABP1 ditunjuk (Auksin-Binding Protein 1). ABP1 adalah 43 kDa glikoprotein dimer dari 22 kDa subunit yang memiliki afinitas tinggi untuk IAA. ABP1 telah diterjemahkan terutama dalam retikulum endoplasma, tapi populasi kecil juga ditemukan terkait dengan membran plasma dan di dinding sel. ABP1 adalah kandidat utama untuk reseptor auksin yang menengahi pemanjangan sel, meskipun bukti untuk peran ini adalah tidak langsung. Mungkin bukti yang paling kuat berasal dari percobaan dengan antibodi. Antibodi protein yang diproduksi oleh sistem kekebalan tubuh dari hewan dalam menanggapi kehadiran antigen. Antibodi akan
9

mengikat dengan antigen, biasanya '' asing '' protein, untuk membuat protein tidak aktif.
Antibodi (IgG yang ditunjuk) dapat diajukan terhadap protein nabati dengan menyuntikkan protein dimurnikan menjadi binatang seperti mouse atau kelinci. Antibodi adalah alat yang berguna karena kekhususan reaksi antigen-antibodi. Antibodi juga dapat '' tag '' dengan bahan kimia fluorescent atau penanda lain sehingga lokasi mereka dapat dengan mudah divisualisasikan dengan mikroskop. Antibodi yang diajukan terhadap protein auksin mengikat (ditunjuk IgG-antiABP) khusus menghambat baik auksin diinduksi koleoptil elongasi dan auksin diinduksi hyperpolarization dari membran plasma. Juga, IgG-antiABP diterapkan untuk koleoptil bagian terlokalisasi dalam sel-sel epidermis luar, yang diyakini sebagian besar sel auksin-responsif dalam koleoptil.
Saran bahwa ABP1 adalah auksin-reseptor telah menarik beberapa kontroversi. Kesulitan utama harus dilakukan dengan lokasi ABP1 dalam sel. ABP1 terutama ditemukan dalam lumen retikulum endoplasma (ER) dan beberapa peneliti telah mampu mendeteksi ABP1 setiap di membran plasma. ABP1 bahkan mengandung sekuens asam amino yang di kedua ujung molekul yang khas dari protein biasanya ditahan dalam lumen ER. Namun, immunolocalization lebih sensitive teknik sekarang telah dikonfirmasi populasi kecil (mungkin 1000 molekul) pada membran plasma protoplas jagung. Masalah kedua adalah bahwa, berdasarkan urutan asam amino, protein ABP1 tampaknya tidak memiliki domain membran-spanning lipofilik. Untuk mendamaikan pengamatan ini, telah diusulkan bahwa ABP1 membentuk kompleks dengan protein transmembran docking. Menurut model ini, docking protein menyediakan kelarutan lipid yang diperlukan untuk jangkar ABP1 ke membran. The ABP1-docking kompleks protein ini kemudian diekspor dari UGD ke membran plasma di manadimasukkan dengan ABP1 menghadap luar (Gambar 18.8B). Telah diusulkan bahwa kompleks protein ABP1-docking itu sendiri tidak aktif, tapi lampiran dari suatu molekul auksin mengaktifkan kompleks dan memulai jalur transduksi sinyal. Docking protein yang diusulkan belum diidentifikasi, tetapi ada beberapa saran yang mungkin reseptor GCPR di keluarga G-protein (Bab 17).Auksin juga mengaktifkan enzim fosfolipase A2 (PLA2) dan beberapa percobaan telah terlibat PLA2
dalam rantai transduksi sinyal. Misalnya, aktivasi PLA2 dapat diblokir oleh IgG-antiABP. Juga, baik lysophospholipids dan asam lemak (produk dari PLA2) merangsang sekresi proton dan elongasi. Efek ini dihambat oleh vanadat, yang secara khusus blok membran plasma proton-ATPase.Data ini menunjukkan bahwa PLA2 berikut ABP1 dalam rantai dan bahwa lysophospholipids dan asam lemak muncul lebih jauh. Akhirnya, kedua IAA dan lysophospholipids efek pada sekresi proton dan elongasi dapat diblokir oleh inhibitor protein kinase, menunjukkan bahwa lipid mengaktifkan proton-ATPase dengan keterlibatan kaskade protein kinase. Sebuah model yang menggambarkan bagaimana komponen ini mungkin berinteraksi disajikan pada Gambar 18.8B.
18,10 PEMELIHARAAN AUKSIN-TERINDUKSI PERTUMBUHAN DAN AUKSIN LAINNYA EFEK MEMBUTUHKAN GENE AKTIVASI
Hipotesis asam pertumbuhan tidak saja menyelesaikan pertanyaan tentang bagaimana auksin mengatur pertumbuhan sel, apalagi yang lebih kompleks masalah perkembangan seperti pematangan sel dan diferensiasi. Salah satu kesulitan adalah bahwa bagian batang hijau, yang menanggapi auksin, tidak merespon dengan baik (jika sama sekali) terhadap asam. Kesulitan lain adalah bahwa asam eksogen menginduksi hanya stimulasi pertumbuhan fana koleoptil. Baik asam maupun fusicoccin efektif setelah yang pertama 30 sampai 60 menit. Kinetika pertumbuhan auksin diinduksi menunjukkan peningkatan yang pesat awal dalam tingkat pertumbuhan yang mencapai maksimal dalam waktu 30 sampai 60 menit. Meledak awal ini diikuti dengan tingkat yang stabil atau secara bertahap menurun selama 16 jam berikutnya (Gambar 18.9). Penjelasan yang paling masuk akal untuk sebuah kurva respon dua fase adalah bahwa respon asam-pertumbuhan terbatas terutama untuk respon pertumbuhan awal yang cepat. Faktor auksin-diatur tambahan kemudian harus diperlukan untuk pemeliharaan pertumbuhan dalam jangka panjang, termasuk perkembangan didefinisikan dengan baik sel melalui pembagian urutan → ekspansi → pematangan → diferensiasi. Faktor-faktor tambahan melibatkan transkripsi gen dan sintesis protein pertumbuhan mempromosikan.
10

Auksin cepat dan secara khusus merangsang transkripsi satu set gen yang dikenal sebagai auksin utama gen responsif. Ini termasuk kedua SAUR (auksin kecil diregulasi RNA) dan AUX / IAA. Gen SAUR mengkodekan singkat, transkrip RNA relatif tidak stabil. Di hipokotil kedelai, ekspresi gen SAUR tampaknya dilokalisasi dalam jaringan yang biasanya menanggapi auxin dan transkrip RNA dapat dideteksi dalam waktu 2 sampai 3 menit auksin aplikasi-bahkan sebelum auksin diinduksi elongasi dapat diamati. Selanjutnya, distribusi asimetris transkrip SAUR telah terdeteksi di bibit gravitasi-dirangsang. Asimetri berkorelasi dengan pemanjangan sel diferensial dalam bibit merespons, tetapi dapat dideteksi bahkan sebelum tanda-tanda yang terlihat dari kelengkungan. Akhirnya, beberapa mutan auksin-tahan di Arabidopsis menunjukkan rendahnya tingkat
Ekspresi SAUR dalam menanggapi pengobatan auksin. Gen AUX / IAA diinduksi selama 4-30 menit penerapan auksin berikut. Ini keluarga besar gen-setidaknya ada 29 berbeda gen AUX / IAA di Arabidopsis genom-yang berfungsi sebagai regulator transkripsi. Protein AUX / IAA tidak mengikat secara langsung dengan DNA, tetapi mengerahkan efek peraturan mereka dengan berinteraksi dengan protein lain yang disebut faktor respon auksin (ARF). ARFs mengikat daerah promoter gen auksin-responsif dan dapat bertindak baik untuk mengaktifkan atau menekan ekspresi gen. Karena protein AUX / IAA menekan aktivitas ARFs, mereka dapat bertindak baik sebagai regulator positif atau negatif.
Studi awal menunjukkan bahwa banyak dari gen responsif juga bisa disebabkan oleh sintesis protein inhibitor cycloheximide. Pengamatan ini menunjukkan bahwa gen ini dapat dikendalikan oleh protein represor berumur pendek yang biasanya mencegah transkripsi. Menurut satu model, auksin dianggap memulai degradasi ubiquitin-dimediasi protein represor ini.
Model ini telah dikonfirmasi dengan ditemukannya gen TIR1 di Arabidopsis. Awalnya diidentifikasi di layar genetik untuk inhibitor transportasi auksin (maka nya nama Transportasi Inhibitor Response 1), ia segera menunjukkan bahwa TIR1 adalah protein larut, nuklir terletak auksin-reseptor yang bekerja sama dengan auksin untuk derepress transkripsi
auxin- gen responsif. TIR1 adalah protein F-kotak (lihat Bab 17, Box 17.3, untuk peran protein F-kotak). Namun, selain memiliki situs pengenalan yang memungkinkan untuk mengikat dengan perancah SCF, TIR1 juga memiliki situs pengakuan untuk auksin. Sebuah studi baru-baru struktur kristal TIR1 telah menunjukkan bahwa pada permukaan protein ada saku yang mengakomodasi peptida AUX / IAA. Namun, afinitas TIR1 untuk AUX / IAA sangat rendah kecuali molekul auksin juga hadir. Molekul auksin duduk di bawah saku di mana ia secara bersamaan berinteraksi dengan kedua protein. Auksin sehingga berfungsi sebagai '' lem molekul '' yang meningkatkan TIR1-AUX / IAA mengikat. Setelah kedua auksin dan AUX / protein IAA berada di tempat, TIR1 kemudian mampu menghubungkan dengan kompleks SCF untuk ubiquitination berikutnya dan degradasi represor oleh ubiquitin-26S proteasome jalur (Gambar 18,10).
Penghapusan protein represor AUX / IAA derepresses gen auksin-responsif, memungkinkan gen untuk melanjutkan dengan transkripsi messenger RNA dan, sebagai konsekuensi, terjemahan dari protein auksin diinduksi. Auksin muncul untuk memodulasi pembangunan melalui depresi gen auksin-responsif, tidak melalui aktivasi sederhana.
Sebagai catatan, itu adalah menarik bahwa studi kristalografi sekarang membuatnya lebih mudah untuk menjawab pertanyaan lama - '? Apa yang membuat auksin' '' Pada dasarnya setiap molekul yang cocok ke dalam saku mengikat TIR1 untuk meningkatkan TIR1-AUX / IAA Interaksi akan memenuhi syarat sebagai auksin. Efektivitas relatif dari molekul auksin yang berbeda tergantung pada seberapa baik mereka cocok dalam saku.
18,11 ASPEK BANYAK TANAMAN PEMBANGUNAN YANG TERKAIT DENGAN POLAR TRANSPORT AUKSINTransportasi auksin Telah alami telah dipelajari hampir secara eksklusif di bibit muda, di mana sintesis berlangsung dalam jaringan aktif berkembang biak. Dari wilayah ini tampaknya ada aliran auksin mengalir menuruni menembak ke akar. Setidaknya dalam bibit Arabidopsis, beberapa aliran ini dampaknya bergerak ke bawah gradien konsentrasi dalam floem. Sebagian besar, bagaimanapun,
11

bergerak melalui kompleks, sangat diatur mekanisme transportasi kutub. Transportasi kutub awalnya dijelaskan berdasarkan Gerakan preferensial naik atau turun di koleoptil rumput, batang, dan akar (Gambar 18.11). Ketika gerakan ini jauh dari puncak morfologi menuju dasar morfologi dari jaringan transportasi, yangarah gerakan digambarkan sebagai basipetal. Gerakan dalam arah yang berlawanan, menuju puncak morfologi, disebut sebagai acropetal. Ketika batang atau koleoptil bagian terbalik, seperti yang ditunjukkan pada Gambar 18.11, arah gerakan asli dipertahankan. Namun, karena lebih banyak belajar tentang transportasi auksin, semakin jelas itu menjadi yang diarahkan transportasi auksin mungkin lateralis serta naik dan turun.
GAMBAR 18,10 Model untuk auksin diinduksi derepresi gen. (1) protein faktor respon Auksin (ARF) berikatan dengan DNA di daerah promoter dari gen auksin-responsif, tapi transkripsi gen dicegah oleh kehadiran protein represor AUX / IAA. Ketika tingkat auxin yang tinggi, auksin (A) menggabungkan dengan reseptor auksin nuklir terletak, TRI1, untuk membentuk sebuah auksin-TRI1 kompleks (2). Auksin meningkatkan afinitas TRI1 untuk AUX / IAA dan memfasilitasi disosiasi AUX / IAA dari (3) ARF. Penghapusan protein AUX / IAA dari ARF derepresses gen (4), yang memungkinkan transkripsi mRNA dan translasi protein auksin-diinduksi, termasuk AUX / IAA (5). Sementara itu, TRI1 merekrut AUX / IAA ke E3 ubiquitin-ligating enzim, atau SCF kompleks (6), di mana
(7) AUX / IAA polyubiquitinated. The ubiqitinated protein kemudian direkrut ke 26S proteasome (8), di mana ia terdegradasi. Hasilnya adalah bahwa ketika tingkat auxin yang tinggi, TIR1 memfasilitasi transkripsi aktif mRNA dengan terus mengeluarkan protein represor. Ketika kadar auxin rendah, TIR1 tidak dapat mengikat dengan represor, protein represor terakumulasi, dan transkripsi dimatikan.
GAMBAR 18,11 Polaritas dalam transportasi auksin dalam segmen oat koleoptil. Blok donor mengandung 14C-IAA. Terlepas dari orientasi segmen, translokasi dari radio berlabel IAA selalu dari ujung morfologis apikal (A) sampai akhir morfologis basal (B) dari segmen.
Transportasi kutub auksin di tunas cenderung didominasi basipetal pada kecepatan di suatu tempat antara 5 dan 20 mm hr-1. Acropetal transportasi di tunas minimal. Dalam akar, di sisi lain, tampaknya ada dua aliran transportasi. Aliran acropetal, tiba dari menembak, mengalir melalui sel-sel parenkim xilem di silinder pusat akar dan mengarahkan auksin menuju ujung akar. Aliran basipetal kemudian berbalik arah aliran, bergerak auksin jauh dari ujung akar, atau basipetally, melalui epidermis luar dan file sel kortikal.
Fenomena transport auksin kutub telah menarik perhatian luas karena asumsi bahwa konsentrasi auksin merupakan variabel penting dalam beberapa tanggapan perkembangan. Gradien auksin karena transportasi kutub telah dipanggil untuk menjelaskan, setidaknya sebagian, fenomena perkembangan seperti dominasi apikal, pembentukan akar adventif dan sekunder, dan tanggapan pertumbuhan diferensial terhadap cahaya dan gravitasi. Aliran auksin di root, misalnya, adalah erat terlibat dalam respon root untuk gravitasi dan akan dibahas dalam bab berikutnya.
Beberapa pengamatan menunjukkan bahwa transportasi kutub melibatkan, mekanisme transpor aktif carrier-dimediasi di kedua tunas dan akar. Pertama, dapat ditunjukkan bahwa transportasi kutub dihambat oleh anaerobiosis atau racun pernafasan seperti sianida dan 2,4-dinitrophenol. Hal ini dianggap bukti bahwa transportasi kutub adalah energi yang membutuhkan tergantung pada metabolisme oksidatif
12

di mitokondria proses. Kedua, bahan kimia tertentu, yang disebut phytotropins, telah dikenal untuk beberapa waktu untuk lebih spesifik, inhibitor nonkompetitif transportasi kutub.
Ini termasuk TIBA (asam 2,3,5-Triiodobenzoic), morphactin (asam 9-hydroxyfluorine-9-karboksilat), dan NPA (N-1-naphthylphthalamic asam) (Gambar 18.12). Hal ini diduga bahwa inhibitor seperti memblokir transportasi auksin dengan mengikat molekul pembawa diskrit yang terlibat dalam sistem transportasi kutub. Ketiga, penyerapan IAA radioaktif setidaknya sebagian dihambat oleh nonradioactive IAA. Pengamatan terakhir ini menunjukkan bahwa IAA berlabel dan tidak berlabel IAA bersaing satu sama lain untuk jumlah terbatas situs operator.
Observasi ini membentuk dasar untuk model kemiosmotik untuk transportasi auksin, diusulkan oleh PH Rubery, AR Sheldrake, dan JA Raven di pertengahan 1970-an. Dalam bentuk yang sekarang, model kemiosmotik berisi tiga fitur penting: (1) gradien pH atau proton kekuatan motif melintasi membran plasma yang menyediakan kekuatan pendorong untuk penyerapan IAA, (2) masuknya pembawa IAA, dan (3) sebuah IAA penghabisan pembawa yang istimewa terletak di dasar sel auksin-mengangkut (Gambar 18,13). Prinsip-prinsip model kemiosmotik dapat diringkas sebagai berikut. IAA adalah lemah sebuah asam, molekul lipofilik. Tergantung pada pH, IAA mungkin ada baik dalam bentuk terprotonasi (IAAH) atau tidak terprotonasi, bentuk anion (IAA-). Ruang dinding sel ini cukup asam dengan pH sekitar 5,5. Pada pH itu, sekitar 20 persen dari IAA akan terprotonasi (IAAH). Akibatnya, ruang dinding sel akan mengandung anion dan terprotonasi IAA. Berdasarkan kelarutan lipid yang, sebagian kecil dari molekul bermuatan IAAH akan diharapkan untuk meredakan perlahan melintasi membran plasma dari ruang dinding sel ke dalam sel. Sebagian besar IAA, bagaimanapun, akan masuk ke dalam sel sebagai IAA- melalui H + / auksin symport pembawa (carrier masuknya) yang merata di sekitar sel.
Setelah di sitoplasma, di mana pH lebih dekat ke 7,0, IAAH akan terpisah IAA- dan H +. Auksin kini terperangkap di dalam sel karena IAA- tidak bisa mudah berdifusi melintasi membran. Kunci untuk
GAMBAR 18,13 Model difusi kemiosmotik-polar untuk transportasi polar IAA. Dalam ruang dinding sel asam (pH 5,5) sekitar 20% dari IAA terprotonasi. Terprotonasi IAA (IAAH) dapat masuk sel dengan difusi melintasi membran sel (putus-putus panah) sedangkan bentuk anion (IAA-) dapat diambil melalui AUX1 (lingkaran), proton / IAA symport pembawa terletak secara acak di membran plasma. Di dalam sel (pH 7,0) bentuk terdeprotonasinya IAA- akan mendominasi. IAA- dapat keluar sel hanya melalui operator penghabisan dari keluarga PIN (kotak) yang terletak istimewa di dasar sel. Membran-terikat pompa ATPase-proton membantu untuk mempertahankan pH diferensial yang tepat melintasi membran dan memberikan proton untuk IAA / H + symport. The unik Lokasi basal dari operator penghabisan adalah kunci untuk transportasi kutub.
model kemiosmotik, bagaimanapun, adalah keberadaan carrier, yang terletak hanya di membran basal sel, yang memediasi penghabisan dari IAA- dari sel. Ini adalah lokasi yang unik dari operator penghabisan ini, lebih dari faktor lain, yang menetapkan polaritas dalam transportasi auksin.
Bukti langsung pertama untuk keberadaan pembawa penghabisan basal mengambil keuntungan dari fakta bahwa protein IAA-transportasi diduga mengikat NPA phytotropin. Protein NPA mengikat itu terisolasi, antibodi yang diajukan terhadap itu, dan antibodi kemudian diberi label dengan pewarna fluorescent fluorescein untuk membuat ntibodies terlihat di bawah mikroskop. Ketika kacang bagian batang diobati dengan antibodi berlabel, fluorescein ditemukan dilokalisasi pada membran plasma basal dari sel induk. Baru-baru ini, sebagian besar karena studi mutan auksin dari Arabidopsis, dua kandidat yang baik untuk auksin masuknya dan penghabisan operator telah diidentifikasi. Pembawa masuknya diduga merupakan protein membran, AUX1.
13

Gen AUX1 telah dikaitkan dengan metabolisme auksin dan transportasi karena mutasi pada saat itu pertumbuhan akar lokus pameran IAA-tahan, mengurangi inisiasi akar lateral, dan respon berkurang dari akar gravitasi. Fenotipe seperti itu konsisten dengan kapasitas berkurang untuk mengambil IAA. Gen AUX1 telah dikloning dan urutan polipeptida dari protein yang mirip dengan yang dikenal permeases asam amino. Permeases asam amino adalah protein membran yang berfungsi sebagai operator amino acid / proton symport. The homologi protein bersama-sama dengan kesamaan struktural antara IAA dan asam amino prekursor, triptofan, telah menyebabkan saran bahwa fungsi protein AUX1 sebagai symporter auksin / proton.
Dukungan lebih lanjut untuk model ini ditawarkan oleh pengamatan bahwa auksin sintetis NAA mengembalikan respon gravitropic untuk mutan (aux1) bibit. NAA penyerapan oleh sel-sel tidak carrier-mediated, sehingga kehilangan AUX1 tidak mengganggu respon. Sebuah keluarga gen, gen PIN, yang mengkode diduga operator penghabisan auksin juga telah diidentifikasi. (Sebanyak delapan gen PIN kini telah diidentifikasi di Arabidopsis.) Salah satu yang pertama untuk ditemukan adalah gen PIN1 yang mengendalikan perkembangan bunga di Arabidopsis. Mutan pin1 ditandai dengan influorescences yang berakhir pada struktur pinlike dan menunjukkan bukti sedikit atau tidak ada perkembangan kuncup bunga. Transportasi auksin kutub berkurang secara signifikan di influorescences pin1 mutan dan karakteristik mutan dapat menirukan dengan memblokir transportasi polar dengan phytotropins. Seperti yang diperkirakan oleh model kemiosmotik, antibodi fluorescent-label telah menunjukkan bahwa protein PIN1 terlokalisir di membran basal sel parenkim xilem.
Selain itu, sesuai dengan model kemiosmotik, AUX1 dan PIN1 protein terletak di ujung-ujung sel akar floem muda (protophloem). Sebuah gen kedua adalah berbagai disebut PIN2, EIR1, WAV6, atau AGR1. Beberapa nama adalah karena fakta bahwa gen diidentifikasi secara mandiri di laboratorium yang berbeda, semua mutan belajar dengan gangguan respon akar gravitasi. PIN2 itu dinamakan demikian karena mengkode protein yang sangat mirip dengan protein yang dikode oleh PIN1. Seperti dengan
protein PIN1, percobaan immunolocalization telah menunjukkan bahwa protein PIN2 terlokalisir di membran basal (yaitu, terjauh dari ujung akar) dari file sel di korteks akar dan epidermis.
Selain itu, seperti AUX1, struktur protein PIN menyerupai permeases asam amino bakteri dan karenanya adalah calon kemungkinan untuk transporter IAA. Polaritas dalam transportasi auksin merupakan dasar untuk pengembangan tanaman dan protein PIN mengarahkan transportasi ini dengan bergerak dari satu permukaan sel ke yang lain, sesuai dengan perubahan tuntutan asimetri auksin. Satu masalah, misalnya, yang telah lama bingung iologists perkembangan adalah bagaimana sumbu apikal-basal didirikan pada embrio muda. Protein PIN tampak bagian dari kunci. Segera setelah pembagian pertama zigot, protein PIN terletak acropetally di sel basal mengarahkan aliran auksin ke dalam sel apikal, menetapkan bahwa sel sebagai pendiri proembrio tersebut. Sebagai sel apikal berkembang biak untuk membentuk tahap embrio globular, mereka mulai mensintesis auxin sendiri. Protein PIN kemudian bergeser ke lokasi basipetal dan arah membalikkan aliran auksin, sehingga membentuk posisi tiang akar berkembang. Pola perubahan serupa distribusi PIN dan perubahan yang dihasilkan dalam polaritas transportasi auksin sama-sama penting dalam tanggapan lain seperti inisiasi akar sekunder dan tanggapan dari menembak dan akar gravitasi dan pencahayaan sepihak, yang akan dibahas secara rinci dalam bab berikutnya.
RINGKASANHormon banyak bahan kimia alami yang mendalam pengaruh, pada konsentrasi mikromolar, pertumbuhan dan diferensiasi sel tumbuhan dan organ. Efektivitas hormon tergantung pada mempertahankan ukuran kolam renang diatur erat, yang dicapai dengan keseimbangan biosintesis, penyimpanan konjugat tidak aktif, dan degradasi katabolik dari molekul.
Auxins ditandai dengan kemampuan mereka untuk merangsang pemanjangan di koleoptil dan batang segmen tetapi terlibat dalam hampir setiap aspek pengembangan tanaman, termasuk perkecambahan biji, diferensiasi vaskular, pengembangan tunas
14

lateral, inisiasi akar sekunder, respon dari akar dan tunas gravitasi, dan bunga dan perkembangan buah.
Sejumlah besar senyawa sintetik mengungkapkan aktivitas auksin, tapi indole-3-acetic acid (IAA) dianggap auksin hanya alami. Dalam kebanyakan tanaman IAA disintesis dari asam amino triptofan meskipun studi triptofan-memerlukan mutan telah menetapkan bahwa di beberapa tanaman, seperti Arabidopsis, IAA disintesis melalui jalur triptofan-independen. IAA dapat disimpan sebagai konjugat kimia seperti ester glikosil, yang akan merilis aktif IAA pada hidrolisis enzimatik. Glikosil ester merupakan sumber penting dari IAA selama perkecambahan biji. Setelah IAA telah dicapai tujuannya, dapat dihilangkan dengan peroksidasi untuk tidak aktif produk atau konversi ke amino konjugat asam. Auksin dapat diangkut dalam floem atau sel-sel dengan transportasi kutub. Kunci untuk transportasi kutub adalah lokasi operator penghabisan di dinding sel tertentu.Peran auksin dalam pembesaran sel digambarkan oleh hipotesis asam-pertumbuhan. Pusat untuk hipotesis ini adalah kegiatan expansins; enzim yang melemahkan cross-link antara molekul selulosa, meningkatkan dinding diperpanjang, dan memungkinkan untuk turgor diinduksiekspansi sel. Auksin juga bertindak untuk derepress gen dengan menargetkan protein represor degradasi oleh 26S proteasome jalur, sebuah proses yang menyumbang tanggapan perkembangan auksin-diinduksi.
Full translated with Google translator
15