5 Cara Mencari Entalpi
Transcript of 5 Cara Mencari Entalpi
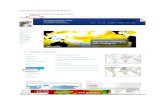
Dari diagram di atas, harga x = …
a. - 197 kJ d. + 1383 kJ
b. + 197 kJ e. - 1970 kJ
c. - 1383 kJ
Jawab: A
H1 = H2 + H3
- 790 = - 593 + H3
H3 = - 197 kJ
2 S (s) + 3 O2 (g) 2 SO3 (g)
2 SO2 (g) + O2 (g)
H1 = - 790 kJ
H2 = - 593 kJ H3 = x kJ
2 S (s) + 3 O2 (g)
2 SO2 (g) + O2 (g)
2 SO3 (g)- 790,4 kJ
- 196,6 kJ
H
Dari diagram di atas, harga Hf untuk reaksi
S (s) + O2 (g) SO2 (g) adalah …
a. 296,9 kJ/mol d. -593,8 kJ/mol
b. -296,9 kJ/mol e. 987,0 kJ/mol
c. 593,8 kJ/mol
Jawab: B
H untuk 2 S (s) + 2 O2 (g) 2 SO2 (g) :
-790,4 = H + (- 196,6)
H = -790,4 + 196,6
H = - 593,8 kJ
H untuk S (s) + O2 (g) SO2 (g) :
SO2 = 1 mol H = ½ (- 593,8)
= - 296,9 kJ
Diketahui:
C6H12O6 + 6 O2 6 CO2 + 6 H2O H = -2820 kJ
C2H5OH + 3 O2 2 CO2 + 3 H2O H = -1380 kJ
Perubahan entalpi bagi reaksi fermentasi glukosa:
C6H12O6 2 C2H5OH + 2 CO2 adalah …
a. + 60 kJ d. -1440 kJ
b. -60 kJ e. +2880 kJ
c. +1440 kJ
Jawab: B
Reaksi yang diminta: C6H12O6 2 C2H5OH + 2 CO2
• Reaksi (1), letak C6H12O6 sama & koefisien sama H tetap
• Reaksi (2), letak dibalik & koefisien dikali 2 H jadi (+) kemudian nilainya dikali 2
C6H12O6 H = -2820x 1
=–2820 kJ
C2H5OHH =
+1380
x 2
=+2760 kJ +
Entalpi pembakaran gas C2H4 = a kJ/mol. Jika entalpi pembentukan
CO2 (g) dan H2O (l) berturut-turut sebesar b kJ/mol dan c kJ/mol,
maka entalpi pembentukan C2H4 (g) adalah …
a. a + b + c d. a + 2b + 2c
b. a – b – c e. –a + 2b + 2c
c. a – 2b – 2c
Jawab: E
H = a kJ/mol
H = Hf (kanan) – Hf (kiri)
a = (2b + 2c) – x
x = 2b + 2c – a
C2H4 + 3 O2 2 CO2 + 2 H2O
x 0 2(b) 2(c)
Jika diketahui energi ikatan N N = 946 kJ/mol dan H – H
= 436 kJ/mol, dan reaksi:
2 NH3 (g) N2 (g) + 3 H2 (g) H = +92 kJ
maka energi ikatan rata-rata N – H adalah …
a. 1173,0 kJ d. 195,5 kJ
b. 586,5 kJ e. 159,5 kJ
c. 391,0 kJ
Jawab: C
H = EI (kiri) - EI (kanan)
+92 = (6 . N – H) – (N N + 3 . H – H)
+92 = (6 . N – H) – (946 + 3 x 436)
N – H = = 391 kJ 6
2254 92
2 H–N–H N N + 3 H–H H = + 92 kJ|H
Jika 100 cm3 larutan NaOH 1 M direaksikan dengan 100 cm3 HCl 1
M dalam sebuah bejana, ternyata suhu larutan naik dari 29 C
menjadi 37,5 C. Jika larutan dianggap sama dengan air, kalor jenis
4,2 J/g.K, massa jenis air 1 g/cm3, maka H netralisasi adalah …
a. +82,3 kJ/mol d. -54,6 kJ/mol
b. +71,4 kJ/mol e. -45,9 kJ/mol
c. -71,4 kJ/mol
Jawab: C
Q = m . c . t = (100 + 100) (4,2) (37,5 – 29) = 7149 J
100 cm3 NaOH 1 M = (0,1 L) (1 M) = 0,1 mol
100 cm3 HCl 1 M = (0,1 L) (1 M) = 0,1 mol
Netralisasi: NaOH + HCl NaCl + H2O
0,1 mol 0,1 mol
H = kJ 71,4- J 71400- 0,1
7140-
mol
Q-